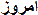
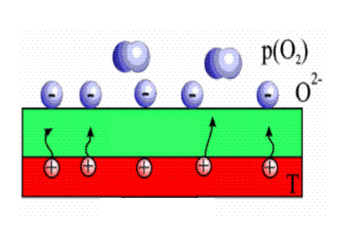
واکنشی را که در آن ، تبادل الکترون صورت میگیرد، واکنش اکسیداسیون- احیا Oxidation - reduction نامیده میشود.

تبادل الکترونی
پس در نتیجه تبادل الکترونی بین یک اکسید کننده و یک احیا کننده یک واکنش شیمیایی رخ می دهد.
فرآیند اکسیداسیون (اکسایش)
فرآیندی است که در آن یک جسم (اکسید کننده) الکترون میگیرد و عدد اکسایش یک اتم افزایش مییابد.
فرآیند احیا (کاهش)
فرایندی است که در آن یک جسم (احیا کننده) الکترون از دست میدهد و عدد اکسایش یک اتم کاهش مییابد.
مثالی از واکنشهای اکسایش و کاهش
بر این اساس ، واکنش زیر یک واکنش اکسایش و کاهش میباشد. چون عدد اکسایش اتم S از صفر به +4 افزایش پیدا میکند و میگوییم گوگرد اکسید شده است و عدد اکسایش اتم O از صفر به -2 کاهش پیدا کرده است و میگوییم اکسیژن کاهیده شده است:
که در آن ، در طرف اول عدد اکسیداسیون هر دو ماده صفر و در طرف دوم ، عدد اکسیداسیون گوگرد در ترکیب +4 و اکسیژن ، -2 است.
اما در واکنش زیر اکسایش- کاهش انجام نمیشود، زیرا تغییری در عدد اکسایش هیچ یک از اتمها به وجود نیامده است:
که در SO2 ، عدد اکسیداسیون S و O بترتیب ، +4 و -2 و در آب ، عدد اکسیداسیون H و O بترتیب +1 و -2 و در اسید در طرف دوم ، عدد اکسیداسیون H و S و O بترتیب ، +1 ، +4 و -2 است.
عامل اکسنده و عامل کاهنده
با توجه به چگونگی نسبت دادن اعداد اکسایش ، واضح است که نه عمل اکسایش و نه عمل کاهش بتنهایی انجام پذیر نیستند. چون یک ماده نمیتواند کاهیده شود مگر آن که همزمان ماده ای دیگر ، اکسید گردد، ماده کاهیده شده ، سبب اکسایش است و لذا عامل اکسنده نامیده میشود و مادهای که خود اکسید میشود، عامل کاهنده مینامیم.
بعلاوه در هر واکنش ، مجموع افزایش اعداد اکسایش برخی عناصر ، باید برابر مجموع کاهش عدد اکسایش عناصر دیگر باشد. مثلا در واکنش گوگرد و اکسیژن ، افزایش عدد اکسایش گوگرد ، 4 است. تقلیل عدد اکسایش ، 2 است، چون دو اتم در معادله شرکت دارد، کاهش کل ، 4 است.
موازنه معادلات اکسایش- کاهش
دو روش برای موازنه واکنشهای اکسایش- کاهش بکار برده میشود: روش یون- الکترون و روش عدد اکسایش.
روش یون- الکترون برای موازنه معادلات اکسایش- کاهش
در موازنه معادلات به روش یون- الکترون ، دو دستور کار که کمی با هم متفاوتاند، مورد استفاده قرار میگیرد. یکی برای واکنشهایی که در محلول اسیدی انجام میگیرد و دیگری برای واکنشهایی که در محلول قلیایی صورت میپذیرد.
- مثالی برای واکنشهایی که در محلول اسیدی رخ میدهد، عبارت است:
این واکنش موازنه نشده ، طی عملیات زیر موازنه می شود:
_ابتدا معادله را به صورت دو معادله جزئی که یکی برای نشان دادن اکسایش و دیگری برای نشان دادن کاهش است، تقسیم کرده و عنصر مرکزی را در هر یک از این نیم واکنش ها موازنه می کنیم:
_اتمهای O و H را موازنه میکنیم. در سمتی که کمبود اکسیژن دارد، به ازای هر اکسیژن یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دیده میشود، با افزودن تعداد مناسب +H آن را جبران می کنیم. در مثال بالا، طرف راست ، معادله جزئی اول 7 اتم اکسیژن کم دارد، پس به طرف مزبور 7H2O افزوده میشود. پس اتمهای H معادله جزئی اول را با اضافه کردن چهارده +H به طرف چپ معادله، موازنه میکنیم. معادله جزئی دوم ، بصورت نوشته شده ، از لحاظ جرمی ، موازنه است:
_در مرحله بعد ، باید معادلات جزئی را از نظر بار الکتریکی موازنه میکنیم. در معادله جزئی جمع جبری بار الکتریکی طرف چپ برابر +12 و در طرف راست +6 است. 6 الکترون به سمت چپ اضافه میشود تا موازنه بار برای معادله جزئی اول حاصل شود. معادله دوم با افزودن دو الکترون به طرف راست ان موازنه میشود، ولی چون تعداد الکترونهای از دسترفته در یک معادله جزئی باید برابر تعداد الکترونهای بدست آمده در معادله جزئی دیگر باشد، بنابراین طرفین معادله جزئی دوم را در 3 ضرب میکنیم:
_معادله نهایی ، با افزایش دو معادله جزئی و حذف الکترونها بدست میآید:
- مثالی برای واکنش هایی که در محلول قلیایی صورت میگیرد:
_معادله به دو معادله جزئی تقسیم می شود:
_برای موازنه H و O در این واکنشها ، درسمتی که کمبود اکسیژن دارد، به ازای هر اتم اکسیژن -2OH و سمت دیگر یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دارد به ازای هر اتم هیدروژن ، یک H2O و در سمت مقابل یک -OH اضافه میکنیم. سمت راست معادله جزئی اول دو اتم O کم دارد. لذا -4OH به سمت راست و 2H2Oبه سمت چپ میافزاییم:
برای موازنه جرمی معادله جزئی دوم ، باید چهار اتم هیدروژن به سمت راست اضافه کنیم، لذا 4H2O به سمت راست و -4OH به سمت چپ اضافه میکنیم:
_برای موازنه بار الکتریکی ، هر جا لازم است، الکترون اضافه میکنیم و در این جا بطرف چپ معادله جزئی اول ، سه الکترون و بطرف چپ معادله جزئی دوم ، چهار الکترون افزوده میشود و برای موازنه کردن الکترونهای بدست آمده و از دست رفته ، مضرب مشترک گرفته و معادله اول را در 4 و معادله دوم را در 3 ، ضرب میکنیم:
_جمع دو معادله جزئی، معادله نهایی را بدست میدهد:
روش عدد اکسایش برای موازنه واکنشهای اکسایش- کاهش
موازنه شامل سه مرحله است. برای مثال واکنش نیتریک اسید و هیدروژن سولفید را در نظر میگیریم. معادله موازنه نشده به قرار زیر است:
_برای تشخیص اتمهایی که کاهیده یا اکسیده میشوند، اعداد اکسایش آنها را از معادله بدست میآوریم:
نیتروژن کاهیده شده (از +5 به +2 ، کاهشی معادل 3 در عدد اکسایش) و گوگرد اکسید شده است (از -2 به صفر ، یعنی افززایشی معادل 2 در عدد اکسایش).
_برای ان که مجموع کاهش در اعداد اکسایش برابر با مجموع افزایش این اعداد باشد، ضرایبی متناسب به هر ترکیب نسبت میدهیم:
_موازنه معادله را ، با بررسی دقیقتر ، کامل میکنیم. در مراحل پیشین تنها موازنه موادی مطرح شد که اعداد اکسایش انها تغییر میکند. در این مثال ، هنوز ضریبی برای H2O در نظر گرفته نشده است. ولی ملاحظه میشود که در سمت چپ واکنش 8 اتم H وجود دارد. همان سمت 4 اتم O نیز اضافی دارد. بنابراین ، برای تکمیل موازنه ، باید در سمت راست معادله ، 4H2O نشان داده شود:
پس معادلات اکسایش- کاهش مانند واکنشهای الکتروشیمیایی و واکنش های یونی را میتوان با یکی از دو روش نامبرده موازنه کرد.

با سلام . به وبگاه رسمی علم و دانش خوش آمدید ! من شایان شیت ره هستم دانش آموز دبیرستان سلام صادقیه ! این پروژه تحقیقی بنده است . تا این جا 77 مطلب ثبت گردیده . امید وارم از این مطالب نهایت استفاده رو ببرید . با تشکر مدیریت !
بازدید دیروز : 26
کل بازدید : 46148
کل یاداشته ها : 77
 شکستن...
شکستن...