دید کلی
شیمی کوانتومی ، دانش کاربرد مکانیک کوانتومی در مسایل مربوط به شیمی است. اثر شیمی کوانتومی ، در شاخههای وابسته به شیمی قابل لمس است. مثلا :
- علمای شیمی فیزیک ، مکانیک کوانتومی را (به کمک مکانیک آماری) در محاسبات مربوط به خواص ترمودینامیکی (مانند آنتروپی و ظرفیت حرارتی) گازها ، در تفسیر طیفهای مولکولی به منظور تائید تجربه خواص مولکولی (مانند طولها و زوایای پیوندی) ، در محاسبات نظری خواص مولکولی ، برای محاسبه خواص حالات گذار واکنشهای شیمیایی به منظور برآورد ثابتهای سرعت واکنش ، برای فهم نیروهای بین مولکولی و بالاخره برای بررسی ماهیت پیوند در جامدات بکار میبرند.
- علمای شیمی آلی از مکانیک کوانتومی ، برای برآورد پایداریهای نسبی مولکولها ، محاسبه خواص واسطههای واکنش ، بررسی ساز و کار واکنشهای شیمیایی ، پیش بینی میزان ترکیبات و تحلیل طیفهای NMR استفاده میکنند.
- علمای شیمی تجزیه از مکانیک کوانتومی برای تفسیر شدت و فرکانسهای خطوط طیفی استفاده میکنند.
- علمای شیمی معدنی از نظریه میدان لیگاند که یک روش تقریبی مکانیک کوانتومی است، در توضیح خواص یونهای مرکب فلزات واسطه سود میبرند.
فرضیه پلانک ، سرآغاز مکانیک کوانتومی
در سال 1900، "ماکس پلانک" ، نظریهای ابداع کرد که با منحنیهای تجربی تابش جسم سیاه ، مطابقتی عالی از خود ارائه داد. فرض او این بود که اتمهای جسم سیاه ( مادهای که تمام نورهای تابیده به آن را جذب کند ) ، تنها قادرند نورهایی را گسیل سازند که مقادیر انرژی آنها توسط رابطه hv داده میشود. در رابطه ، v فرکانس تابش و h ، ثابت تناسب است که به ثابت پلانک معروف است. با قبول مقدار 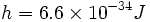 ، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.
، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.
به دنبال پلانک ، "انیشتین" نیز مشاهدات مزبور را بر اساس اندیشه تشکیل نور از اجزایی ذره گونه تشریح کرد که آنها را فوتون نامید که انرژی هر یک از آنها برابر است با: 
احتمال و مکانیک کوانتومی
موضوع احتمال ، یک نقش اساسی را در مکانیک کوانتومی ایفا میکند. در مکانیک کوانتومی ، سروکار ما با احتمالاتی است که با متغیر پیوستهای مانند مختصه x درگیرند. صحبت از احتمال پیدا شدن یک ذره در یک نقطه خاص مانند x = 0.5000 حاوی چندان معنایی نیست، زیرا تعداد نقطهها در روی محور x نامتناهی ، ولی تعداد در اندازه گیریهای ما به هر حال متناهی است و از این رو ، احتمال وصول با دقت به 0.5000 بینهایت کم خواهد بود.
این است که به جای آن از احتمال یافتن ذره در یک فاصله کوتاه از محور x ، واقع بین x+dx , x صحبت میشود که در آن dx یک طول بینهایت کوچک است. طبیعتا احتمال فوق متناسب با فاصله کوچک dx بوده و و برای نواحی مختلف محور x متغیر خواهد بود. بنابراین احتمال اینکه ذره در فاصله مابین x و x+dx پیدا شود، مساوی g(x)dx است که در اینجا (g(x بیانگر نحوه تغییرات احتمال روی محور x است. تابع (g(x چون برابر مقدار احتمال در واحد طول است، لذا چگالی احتمال نامیده میشود.
چون احتمالات ، اعداد حقیقی و غیر منفیاند، لذا (g(x باید یک تابع حقیقی باشد که همه جا غیر منفی است. تابع موج 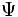 میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل میپذیرد که چگالی احتمال برابر
میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل میپذیرد که چگالی احتمال برابر 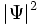 است.
است.
اصل عدم قطعیت هایزنبرگ
اندیشه "بوهر" مبنی بر اینکه هر الکترون در اتم ، تنها میتواند کمیتهای معین انرژی را دارا باشد، گام مهمی در رشد و تکوین نظریه اتمی بود (مدل اتمی بوهر). نظریه بوهر برای توجیه طیف اتم هیدروژن ، مدلی رضایت بخش ارائه کرد، اما تلاش برای بسط نظریه به منظور تشریح طیف اتمهای دارای بیش از یک الکترون ناموفق بود. دلیل این مشکل به زودی آشکار شد.
در نگرش بوهر ، الکترون به عنوان ذرهای باردار متحرک ، در نظر گرفته میشود. برای پیش بینی دقیق مسیر یک جسم متحرک ، دانستن مکان و سرعت جسم در هر لحظه معین ضروری است. اصل عدم قطعیت هایزنبرگ (1926) نشان میدهد که تعیین دقیق مکان و اندازه حرکت جسمی به کوچکی الکترون ناممکن است. هرچه تلاش کنیم که یکی از این کمیتها را دقیقتر تعیین کنیم، از دقت کمیت دیگر ، نامطمئنتر هستیم.
مشاهده اشیا با دریافت انعکاس پرتوهای نوری که برای روشن کردن آنها بکار رفته است، امکانپذیر است. برای تعیین موقعیت جسمی به کوچکی یک الکترون ، تابشی با طول موج به غایت کوتاه مورد نیاز است. چنین تابشی ، طبعا فرکانس بسیار بالایی خواهد داشت و بسیار پرانرژی خواهد بود. وقتی این تابش به الکترون برخورد کند، سبب تغییر تندی و جهت حرکت آن میشود. از این رو هر گونه تلاش برای تعیین موقعیت الکترون ، اندازه حرکت آن را به شدت تغییر میدهد. فوتونهایی که طول موج بلندتر دارند، کم انرژیترند و تاثیر کمتری بر اندازه حرکت الکترون میگذارند، ولی به علت بلندی طول موجشان ، نخواهند توانست موقعیت دقیق الکترون را نشان دهند.
از این رو ، این دو نوع عدم قطعیت با هم مرتبطند. به گفته هایزنبرگ ، حاصلضرب عدم قطعیت در مورد یک شیء ، 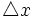 و عدم قطعیت در اندازه حرکت آن ،
و عدم قطعیت در اندازه حرکت آن ، 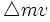 ، برابر یا بزرگتر از حاصل بخش ثابت پلانک ، h و 4π است:
، برابر یا بزرگتر از حاصل بخش ثابت پلانک ، h و 4π است:

عدم قطعیت در اندازه گیری ، برای اشیایی به کوچکی الکترون بسیار مهم است، در حالی که برای اشیا با اندازه معمولی بیاهمیت است.

معادله شرودینگر
اصل عدم قطبیت هایزنبرگ نشان میدهد که هر نوع کوشش در راه جامعتر و دقیق کردن مدل بوهر ، بینتیجه است، زیرا تعیین دقیق مسیر الکترون در یک اتم ناممکن است. از سوی دیگر ، "شرودینگر" ، رابطه دوبروی را برای تدوین معادلهای بکار برد که الکترون را برحسب خصلت موجی آن توصیف میکند.
معادله شرودینگر پایه مکانیک موجی است. معادله برحسب یک تابع موجی 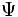 برای الکترون نوشته میشود. وقتی معادله برای الکترون در اتم هیدروژن حل میشود، یک سلسله تابع موجی بدست میآید. هر تابع موجی به یک حالت معین انرژی برای الکترون مربوط است و ناحیهای در اطراف هسته را توضیح میدهد که در آن ، امکان یافتن الکترون وجود دارد. تابع موجی یک الکترون آنچه را که یک اوربیتال نامیده میشود، توضیح میدهد.
برای الکترون نوشته میشود. وقتی معادله برای الکترون در اتم هیدروژن حل میشود، یک سلسله تابع موجی بدست میآید. هر تابع موجی به یک حالت معین انرژی برای الکترون مربوط است و ناحیهای در اطراف هسته را توضیح میدهد که در آن ، امکان یافتن الکترون وجود دارد. تابع موجی یک الکترون آنچه را که یک اوربیتال نامیده میشود، توضیح میدهد.
شدت هر موج ، با مجذور دامنه آن متناسب است. تابع موجی ، 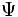 ، تابع دامنه است. مقدار
، تابع دامنه است. مقدار 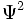 برای یک حجم کوچک در هر موقعیتی در فضا ، متناسب با چگالی بار الکترونی در آن حجم است.
برای یک حجم کوچک در هر موقعیتی در فضا ، متناسب با چگالی بار الکترونی در آن حجم است.
میتوان تصور کرد که بار الکترون به سبب حرکت سریع الکترون به صورت ابر باردار در فضای دور هسته گسترده شده است. این ابر در برخی نواحی غلیظتر از نواحی دیگر است. احتمال یافتن الکترون در هر ناحیه معین متناسب با چگالی ابر الکترونی در آن ناحیه است. این احتمال در ناحیهای که ابر الکترونی غلیظتر است، بیشتر خواهد بود. این تفسیر کوششی برای توصیف مسیر الکترون ، به عمل نمیآورند، بلکه فقط پیش بینی میکند که احتمال یافتن الکترون در کجا بیشتر است.


مقدمه
کشف مادهای که بعدها DNA نام گرفت در سال 1869 بوسیله فردیک میشر انجام شد. این دانشمند هنگام مطالعه بر روی گویچههای سفید خون ، هسته سلولها را استخراج کرد و سپس بر روی آن محلول قلیایی ریخت. حاصل این آزمایش ، رسوب لزجی بود که بررسیهای شیمیایی آن نشان داد، ترکیبی از کربن ، هیدروژن ، اکسیژن ، نیتروژن و درصد بالایی از فسفر میباشد. میشر این ماده را نوکلئین نامید. زمانی که ماهیت اسیدی این ماده مشخص گردید، نام آن به اسید دزاکسی ریبونوکلئیک تغییر یافت.
 |
ساختمان رشتهای DNA
سرعت پیشرفت تعیین ساختمان DNA بسیار کند بوده است. در سال 1930 کاسل و لوین دریافتند که نوکلئین در واقع اسید دزوکسی ریبونوکلئیک است. برسیهای شیمیایی آن مشخص کرد که زیر واحد تکرار شونده اصلی DNA ، نوکلئوتید میباشد که از سه قسمت تشکل شده است. یک قند پنتوز (2?- دزوکسی D- ریبوز) ، یک گروه 5-فسفات و از یکی چهار باز آلی نیتروژندار حلقوی آدنین (A) ، گوانین (G) ، سیتوزین (C) و تیمین (T) تشکیل شده است.
از این چهار باز دو باز آدنین و گوانین از بازهای پورینی و دو باز سیتوزین و تیمین از بازهای پیریمیدینی میباشند. به مجموعه قند و باز آلی نوکلئوزید گفته میشود. گروه فسفات میتواند به کربن3? و یا5? متصل شود. به مجموع نوکلئوزید و گروه فسفات متصل به آن نوکلئوتید میگویند. با توجه به اینکه یون فسفات میتواند هم به کربن 3? و هم به کربن5? متصل شود.
پس دو نوکلئوتید از طریق یک پیوند فسفودی استر بهم متصل میشوند. به این صورت که گروه هیدروکسیل یک نوکلئوتید با گروه فسفات نوکلئوتید دیگر واکنش داده و پیوند فسفودی استر را بوجود میآورد. از آنجایی که پیوند فسفودی استر ، کربنهای3? و5? دو قند مجاور را بهم متصل میکند، این پیوند را پیوند5?-3? فسفودی استر نیز مینامند. یک زنجیره در اثر اتصال پشت سر هم تعدادی2?-دزوکسی ریبونوکلئوتید بوسیله پیوندهای دزوکسی ریبونوکلئوتید تشکیل میشود.
تمامی نوکلئوتیدها در یک زنجیره پلی نوکلئوتیدی دارای جهت یکسان میباشند. به این صورت که نوکلئوتید انتهایی در یک سمت زنجیره دارای یک گروه5? آزاد و نوکلئوتید انتهایی در سمت دیگر زنجیره دارای یک گروه3? آزاد میباشد. بنابراین زنجیره پلی نوکلئوتیدی دارای جهت بوده و این جهت را به صورت5?--->3? نشان میدهند. بنابراین اگر در نوکلئوتید ابتدایی کربن5? در بالای حلقه پنتوز و کربن3? در زیر آن باشد، در تمامی نوکلئوتیدهای بعدی زنجیره کربن 5 در بالای حلقه پنتوز جای خواهد داشت.
نتایج حاصل تا سال 1950
- DNA یک پلیمر رشتهای متشکل از واحدهای2?- دزوکسی اسید ریبونوکلئیک میباشد که بوسیله پیوندهای فسفودی استر5?-3? به هم متصل شدهاند.
- DNA حاوی چهار زیر واحد dc و dG و dT و dA میباشد.
- مقادیر متوالی dT و dA با یکدیگر و dc و dG نیز با یکدیگر مساوی میباشند.
 |
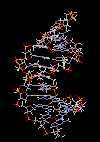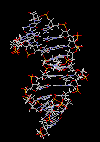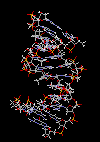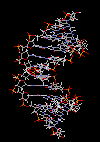
مارپیچ دو رشتهای DNA
در سال 1953 در ساختمان سه بعدی DNA ، بوسیله واتسون و کریک کشف شد. واتسون و کریک با استفاده از مطالعات تفرق اشعه ایکس ، رشتههای DNA که بوسیله فرانکلین و ویلکینز تهیه شده بود و همچنین ساختن مدلها و استنباطهای مشخصی ، مدل فضایی خود را ارائه دادند و در سال 1962 واتسون و کریک و ویلکینز به خاطر اهمیت کشف ساختمان DNA به صورت مشترک جایزه نوبل دریافت کردند.
مدل پیشنهادی آنان چنین بود. DNA یک مارپیچ دو رشتهای است که رشتههای آن به دور یک محور مرکزی ، معمولا به صورت راست گرد پیچ میخورند. طبق مدل واتسون و کریک ، ستونهای قند - فسفات همانند نردههای پلکان به دو قسمت خارجی بازهای آلی پیچیده و به این ترتیب در معرض محیط آبکی داخل سلول هستند و بازهای آلی که خاصیت آبگریزی دارند، در داخل مارپیچ قرار میگیرند. هنگام تشکیل مارپیچ رشتهها به صورت موازی متقابل قرار میگیرند.
یعنی اگر جهت یک رشته3?<--5? باشد، رشته دیگر 5?<--3 خواهد بود. پیوندهای هیدروژنی بین آدنین از یک رشته با باز تیمین رشته مقابل و باز گوانین یک رشته با سیتوزین رشته مقابل بوجود میآیند. گر چه از نظر اندازه هر باز پورینی میتواند در مقابل یک باز پیریمیدین قرار بگیرد. ولی به دلیل وجود گروههای شیمیایی روی بازهای G و C و T و A پیوندهای هیدروژنی مناسب فقط بین C - G و T - A برقرار میشود و ایجاد پیوند بین T - G و C- A ممکن نیست.
واکنشهای توتومریزاسیون
اتم هیدروژن در بازهای آلی میتواند روی اتمهای نیتروژن و یا اکسیژن حلقه جابجا شود. این تغییر موقعیت هیدروژن روی حلقه باز را توتومریزاسیون میگویند. توتومریزاسیون در بازهای آدنین سیتوزین باعث تبدیل فرم آمینی به فرم ایمنی و در مورد بازهای تیمین و گوانین باعث تبدیل فرم کتونی به فرم انولی میشود.
در شرایط فیزیولوژیکی ثابت تعادل واکنش توتومریزاسیون بیشتر به سمت اشکال آمینی و کتونی میباشد. این حالت پایدار پروتونی ، الگوی تشکل پیوندهای هیدروژنی بین بازها را تعیین مینماید، بطوری که بازهای T و A با تشکیل دو پیوند هیدروژنی و بازهای G و C با سه پیوند هیدروژنی با هم جفت میشوند. C و A و همچنین T و G نمیتوانند با هم جفت شوند.
زیرا در این بازها اتمهای هیدروژن هر دو در یک موقعیت قرار دارند و امکان ایجاد پیوند هیدروژنی وجود ندارد. به دلیل اینکه در رشتههای DNA همواره باز A مقابل T و باز G مقابل C قرار دارد، این دو رشته را مکمل مینامند. بنابراین توالی موجود در یک رشته DNA ، توالی رشته مقابل را تعیین میکند. مکمل بودن دو رشته DNA ، اساس عمل همانند سازی DNA است.


مقدمه
پروتئینها از اتصال اسیدهای آمینه به یکدیگر از طریق پیوند پپتیدی بدست میآیند. تشکیل پیوند پپتیدی و قرار گرفتن ترتیب اسیدهای آمینه که برای هر پروتئین اختصاصی است، به سادگی امکان پذیر نیست. به همین دلیل میبایست در یاخته مکانیسم ویژهای وجود داشته باشد که بتواند ویژگی پروتئینها را حفظ کند. بیوسنتز پروتئینها در واقع ترجمه ترتیب نوکلئوتیدی اسید نوکلئیک DNA در مولکول پروتئین است. انتقال اطلاعات از DNA به مولکول پروتئین بوسیله RNAها ، بویژه mRNA امکانپذیر است. بدین ترتیب برای هر پروتئین ، mRNA اختصاصی آن پروتئین وجود دارد.
 |
به عبارت دیگر هر پروتئین در روی DNA ، ژن اختصاصی دارد که اطلاعات آن ژن در mRNA رونویسی و در مولکول ترجمه میشود. در بیوسنتز پروتئینهایی که در ساختارشان بیش از چند اسید آمینه دارند، وجود یک مکانیسم سنتزی که در آن ترکیبات و عوامل بسیاری دخالت میکنند، الزامی است. این مکانیسم به یک سیستم رمز یاب نیاز دارد که بطور خودکار واحد اسید آمینه معینی را در موقعیت ویژهای از زنجیره پروتئینی قرار میدهد.
ترکیبات شرکت کننده در سنتز
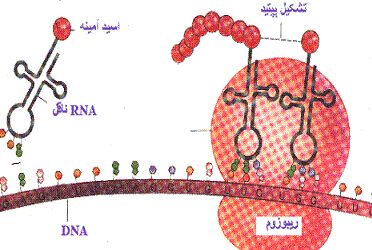
RNA پیک (mRNA)
این RNA اطلاعات مربوط به پروتئین ویژهای را از مولکول DNA میگیرد و به ماشین سنتز کننده پروتئین انتقال میدهد. در ترتیب نوکلئوتیدهای mRNA هر سه نوکلئوتید مجاور بیانگر رمز (کدون) اسید آمینه مشخص هستند و به همین جهت ترتیب نوکلئوتیدها در mRNA بیان کننده ترتیب اسیدهای آمینه در پروتئین است. هر اسید آمینه رمز مشخصی دارد. متیونین و تریپتوفان فقط یک رمز دارند، در حالیکه سایر اسیدهای آمینه واجد دو یا تعداد بیشتری رمز هستند.
رمز میتونین همیشه AUG است که آغاز سنتز را در همه پروتئینها به عهده دارد. در یاختههای پروکاریوت و یوکاریوت ، در هر دو پروتئین سازی با میتونین آغاز میشود. پروتئینهایی که نخستین اسید آمینه آنها میتونین نیست، پس از آغاز میتونین آغازین از مولکول برداشته میشود. سه رمز UGA و UAA و UAG برای پروتئین رمز خوانی نمیکنند، بلکه رمزهایی هستند که پایان سنتز زنجیره پروتئین را بیان میکنند.
RNA ناقل (tRNA)
tRNA ساختار سوم از نوع L دارد که در آن دو ناحیه پذیرنده و آنتی کدون آزادند و بقیه مولکول تاب خورده است. آنتی کدون (پاد رمز) شامل سه نوکلئوتید است که مکمل رمز ویژهای از mRNA است. tRNA از ناحیه پذیرنده یک اسید آمینه اختصاصی را به خود متصل میکند. آنزیم اختصاصی به نام آمینو اسیل- tRNA- سنتتاز این عمل را انجام میدهد. در نتیجه برای هر اسید آمینه دست کم یک tRNA اختصاصی وجود دارد. ولی برخی از اسیدهای آمینه بیش از یک نوع tRNA دارند.
 |
ریبوزومها
ریبوزمها که از اتصال RNA ریبوزومی با تعدادی پروتئین شکل میگیرند، شامل دو زیر واحد هستند که از نظر اندازه و نوع پروتئینها در یوکاریوتها متفاوت هستند. دو زیر واحد در حالت عادی از یکدیگر جدا بوده و در یاخته پراکندهاند. در حالی که با آغاز سنتز پروتئین ، دو زیر واحد به هم متصل شده و یک مجموعه را تشکیل میدهند. در روی ریبوزومها (هر دو زیر واحد) در جایگاه وجود دارد. جایگاه آمینو اسیل که با A نمایش داده میشود و جایگاه پپتیدیل که با P مشخص میشود. هنگامی که دو زیر واحد به هم متصل میشوند، جایگاهها به نحوی قرار میگیرند که کاملا بر همدیگر منطبق باشند.
آنزیم پپتیدیل ترانسفراز یا پپتید سنتتاز
اتصال دو اسید آمینه به یکدیگر یا تشکیل پیوند پتیدی را کاتالیز میکند.
عوامل آغازگر
این عوامل دراز کننده و پایان دهنده یا آزاد کننده زنجیره هستند.
انرژی لازم
انرژی لازم در واکنشها بوسیله GTP تامین میشود.
مراحل سنتز پروتئین(مراحل سنتز در پروکاریوتها)
آغاز سنتز
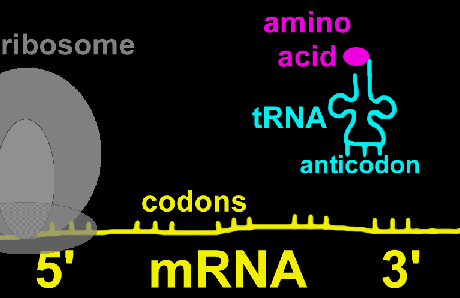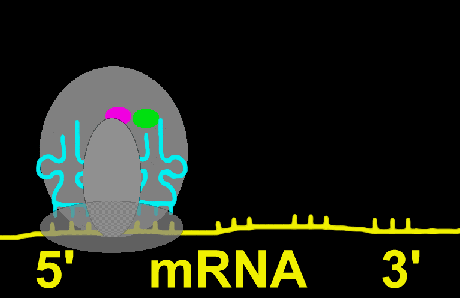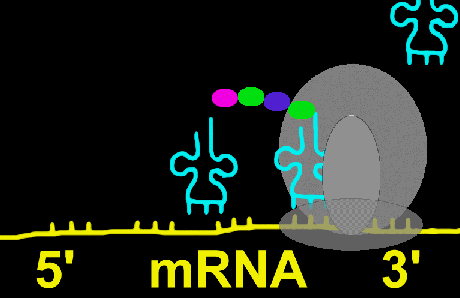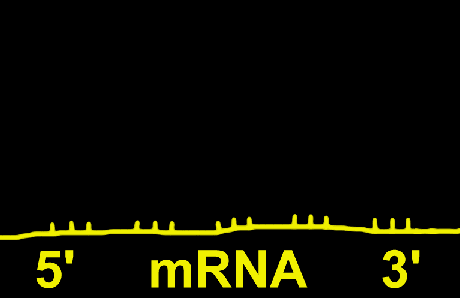
عواملی که در آغاز سنتز زنجیره پروتئین شرکت دارند، عوامل آغازگر خوانده شده و با علامت اختصاصی IF نشان داده میشوند. تا کنون سه نوع آغازگر IF1 , IF2 , IF3 شناسایی و مطالعه شدهاند. رمز آغازگر سنتز در روی mRNA همیشه مربوط به اسید آمینه متیونین بوده و در پروکاریوتها این اسید آمینه حالت فرمیل دار متیونین است. رمز متیونین و یا فرمیل متیونین سه نوکلئوتید AUG است. در مرحله اول ، عامل IF3 به زیر واحد کوچک ریبوزوم متصل میگردد.
سپس mRNA در روی آن طوری قرار میگیرد که رمز AUG در جایگاه P ریبوزوم واقع شود. پس از استقرار mRNA در جایگاه خود IF3 آزاد میگردد. در مرحله بعد عامل IF2 , GTP به tRNA فرمیل متیونین (fMet) متصل شده و مجموعا بر روی زیر واحد کوچک ریبوزوم که حامل mRNA نیز هست، انتقال مییابد. در این حالت زیر واحد بزرگ ریبوزوم به مجموعه فوق به نحوی متصل میشود که جایگاه P و A دو زیر واحد به یکدیگر منطبق شوند.
 |
دراز شدن زنجیره
مرحلهای است که طی آن اسیدهای آمینه تشکیل دهنده زنجیره پروتئین مورد نظر ، یکی یکی با سوار شدن بر روی tRNA ویژه خود ، بر روی ریبوزوم انتقال مییابند و بین آن پیوند پپتیدی ایجاد میشود. در این فرآیند عوامل دراز کننده زنجیره شرکت دارند که با EFG و EFT نشان داده میشوند. ابتدا اسید آمینه دوم بر روی tRNA خود سوار میشود و عوامل GTP و EFG را به خود متصل میکند و مجموعه حاصل به جایگاه A ریبوزوم منتقل میشود. پس از اینکه tRNA کاملا در محل خود ثابت شد، EFT آزاد میشود و GTP به GDP و Pi تبدیل میگردد.
در مرحله بعد بین دو اسید آمینه که یکی در جایگاه P و دیگری در جایگاه A قرار دارد، پیوند پپتیدی تشکیل میشود. این عمل بوسیله آنزیم پپتیدیل ترانسفراز یا پپتیدیل سنتتاز کاتالیز میگردد. در این حالت حرکت ریبوزوم در روی mRNA در جهت 5?--->3? به اندازه یک رمز ، موجب میشود که tRNA موجود در جایگاه p (که اسید آمینه خود را رها کرده) و tRNA پپتیدیل (که اسید آمینه را بر روی خود حمل میکند) از جایگاه A به P انتقال یابد. این مرحله جابجایی نامیده میشود و انجام آن به عامل EFG نیاز دارد. جایگاه A که اکنون خالی شده ، برای پذیرش اسید آمینه سوم آماده میشود. اتصال واحدهای اسید آمینه به همین ترتیب پیش میرود تا اینکه ریبوزوم به انتهای رمز مربوط در روی mRNA برسد.
پایان سنتز زنجیره
پایان سنتز زنجیره پروتئین هنگامی است که ریبوزوم به رمزهای انتهایی روی زنجیره mRNA میرسد. در روی mRNA سه رمز پایانی UGA , UAG , UAA وجود دارند، که پایان سنتز زنجیره را اعلام میکنند. عواملی که در این مرحله شرکت دارند به نام عوامل آزاد کننده R3 و R2 و R1 معروف هستند. اتصال این عوامل به رمزهای پایانی مربوطه ، باعث میشود که آنزیم پپتیدیل سننتاز به جای اینکه پیوند پپتیدی ایجاد کند، مولکول آب را به انتهای زنجیره انتقال دهد. در نتیجه مولکول پروتئین تازه سنتز شده در انتها به عامل COOH پایان مییابد و زنجیره آزاد میگردد و بلافاصله mRNA و سایر عوامل آزاد شده و دو زیر واحد ریبوزومها نیز از یکدیگر جدا میشوند. برای سنتز یک مولکول mRNA چندین ریبوزوم همزمان روی رشته قرار میگیرند و در پروتئین سازی شرکت میکنند.


دید کلی
از سال 1953 که ساختار مولکولی DNA به صورت مارپیچ مضاعف مطرح شد و DNA به عنوان مرکز اطلاعات یاخته و نیز واسطه انتقال اطلاعات از نسلی به نسل دیگر یاختهای مورد تاکید قرار گرفت. مساله اصلی چگونگی دخالت این مولکول در عملکردهای یاختهای بود. از همان زمان این نظر قوت گرفت که سنتز پروتئینها مثل دیگر فرآیندهای زیستی یاختهها تحت کنترل ماده ژنتیکی باشد.
پیشرفتهای حاصل نشان داد که عمل پروتئین سازی در واقع نوعی ترجمه است که طی آن زبان اطلاعاتی DNA و RNA به زبان اسیدهای آمینه تبدیل میشود. توالی اسیدهای آمینه بوسیله RNA پیک (mRNA) تعیین میشود و به عبارت دیگر رمز مربوط به اسیدهای آمینه بر روی mRNA قرار دارد. اما مشخص کردن این امر دشوار و حتی غیر ممکن بنظر میرسید زیرا هیچ روشی برای ایجاد ارتباط مستقیم بین رمز اسیدهای آمینه و mRNA وجود نداشت.
 |
سیر تحولی
- در اوایل دهه 1950 پائول زامک نیک آزمایشاتی را برای تعیین محل سنتز پروتئین در داخل سلول انجام داد و تعیین کرد که سنتز پروتئین در اندامکهایی به نام ریبوزوم صورت میگیرد.
- دومین پیشرفت کلیدی توسط مالون هاگلند بدست آمد که نشان داد اسیدهای آمینه برای شرکت در پروتئین سازی در ریبوزومها ، باید به RNA محلول که بعدها RNA ناقل نامیده شد، متصل شوند.
- سومین پیشرفت کلیدی زمانی حاصل شد که کریک نحوه کد شدن اطلاعات ژنتیکی در زبان 4 حرفی نوکلئوتیدها به زبان 20 حرفی پروتئینها را مورد بررسی قرار داد. لازم به یادآوری است که فقط 20 اسید آمینه در ساختار پروتئینها شرکت دارند.این سه پیشرفت بزودی منجر به شناسایی مراحل اصلی سنتز پروتئین و نهایتا رمز گشایی ماده ژنتیکی گردید که هر اسید آمینه را مشخص میکند.
رمز ژنتیکی (Genetic Code)
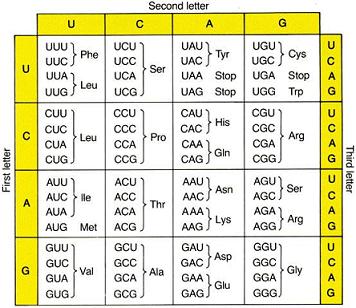
در بین RNA های مختلف فقط RNA پیک حاوی رمز ژنتیکی برای سنتز پروتئینها میباشد. بازهای سازنده RNA پیک فقط 4 نوع هستند در حالی که پروتئینها از 20 نوع اسید آمینه ساخته شدهاند. بنابراین باید بین بازهای موجود در مولکول RNA پیک و اسیدهای آمینه رابطهای وجود داشته باشد تا بتوان رمز 4 حرفی RNA پیک را به رمز 20 حرفی پروتئینها ترجمه کرد. اگر یک نوکلئوتید نماینده یک اسید آمینه فرض شود در این صورت فقط رمز ترجمه چهار اسید آمینه بدست میآید (41).
اگر دو نوکلئوتید برای یک اسید آمینه در نظر گرفته شود در این صورت رمز ترجمه 16 (42) اسید آمینه بدست می آید که البته با مقایسه 20 اسید آمینه کافی نیست. اگر 3 نوکلئوتید را رمز ترجمه یک اسید آمینه فرض کنیم در این صورت 64 (43) رمز برای 20 اسیدآمینه بدست می آید. رمز سه نوکلئوتیدی ، رمز بازهای سه گانه (Triplet) نامیده می شود. RNA حامل ، واسط بین اسیدهای آمینه و بازهای سه گانه RNA پیک در پروتئین سازی است.
 |
آزمایش نیرنبرگ برای تعیین رمز اسید آمینه
برای این که بتوان مکانیسم بیوسنتز پروتئینها را مطالعه کرد. نخست باید مخلوط مناسبی از مواد مختلف داخل سلولی تهیه نمود و با افزایش اسیدهای آمینه رادیواکتیو در این محیط واکنشهای سنتز پروتئینها را روشن ساخت. نیرنبرگ 20 نمونه از این مخلوط تهیه کرد و به هر یک از این نمونهها مقداری پلیمر اسید اوریدیلیک و تنها یکی از 20 اسید آمینه را به صورت رادیواکتیو افزوده و نمونهها را در دمای 37 درجه سانتیگراد قرار داد، رسوب حاصل فقط حاوی اسید آمینه فنیل آلانین است. بنابراین رمز فنیل آلانین در پلی u وجود دارد و باز سه گانه مربوطه uuu است. نیرنبرگ با تکرار آزمایش و انتخاب پلیمرهای مصنوعی دیگر ، بازهای سه گانه ccc را برای رمز پرولین و AAA را برای لیزین تعیین کرد.
روش شیمیایی شناسایی رمزهای سه گانه
نیرنبرگ و یکی از همکاران او به نام لدر با استفاده از روشهای شیمیایی ترینوکلئوتیدهای مختلفی را که ردیف بازهای آنها کاملا معلوم بود تهیه نموده و آنها را به جای پلینوکلئوتیدهای مصنوعی در تجربه فوق مورد استفاده قرار دادند. به کمک این تجربیات دانشمندان فوق به این نتیجه رسیدند که هر باز سه گانه بر روی ریبوزوم قرار گرفته و با یک RNA ناقل که حامل اسیدهای آمینه مربوط به این باز سه گانه است پیوند مییابد. این ترکیب را میتوان با روش صاف کردن روی نیترات سلولز ، به صورت خالص جدا ساخته و اسید آمینه و باز سه گانه موجود در آن را تعیین کرد و رمز مربوطه را شناخت.
 |
رابطه رمز ژنتیکی با سنتز پروتئینها
از 64 باز سه گانه یا کدون سه کدون به کدونهای بیمعنی (Nonsense) معروف هستند، فاقد هر گونه رمز برای اسیدهای آمینه هستند اما دست کم دو تا از آنها حاوی علایم پایانی سنتز پروتئینی میباشند به این معنی که نقطه پایان پلیمر شدن اسیدهای آمینه به صورت پروتئین را تعیین میکنند. 61 کدون باقیمانده حاوی رمزهایی برای انتخاب 20 اسید آمینه هستند و این خود به این معنی است که در رمزهای ژنتیکی بعضی از رمزها تکراری هستند یعنی چند کدون حاوی رمز یک اسید آمینه واحد میباشند.
ویژگیهای عمومی رمزهای ژنتیکی
- رمزهای ژنتیکی گسسته نیستند. یعنی بین آخرین نوکلئوتید یک رمز و اولین نوکلئوتید رمز بعدی فاصلهای وجود ندارد به عبارت دیگر بین دو رمز ژنتیکی ، نوکلئوتیدی بدون رمز وجود ندارند.
- رمزهای ژنتیکی منحصر به فرد و در عین حال مترادف هستند. به این معنی که از یک سو یک رمز ژنتیکی برای اسید آمینهای هم در پروکاریوتها و هم در یوکاریوتها رمزی برای همین اسید آمینه است و به جز متیونین و تریپتوفان هر اسید آمینه بیش از یک رمز دارد (رمزهای مختلف).
- در بین ترادفهای هر رمز ژنتیکی ، تفاوت بطور معمول مربوط به نوکلئوتید سوم است. کمتر اختصاصی بودن باز سوم ، عاملی برای سهولت باز شدن پیوند بین رمز و ضد رمز هنگام سنتز پروتئین است. پدیده تغییر پذیری باز سوم ، انعطاف پذیری نام دارد. پدیده انعطاف پذیری یا لرزش موجب میشود برخی جهشهای ژنی که منجر به تغییر در سومین باز رمز میشوند، اثر نامناسبی در سنتز پروتئین بر جای نگذارند.


دید کلی
اساس شیمیایی بسیاری از واکنشها در موجودات زنده شناخته شده است. کشف ساختمان دو رشتهای دزاکسی ریبونوکلئیک اسید (DNA) ، جزئیات سنتز پروتئین از ژنها ، مشخص شدن ساختمان سه بعدی و مکانیسم فعالیت بسیاری از مولکولهای پروتئینی ، روشن شدن چرخههای مرکزی متابولیسم وابسته بهم و مکانیسمهای تبدیل انرژی و گسترش تکنولوژی Recombinant DNA (نوترکیبی DNA) از دستاوردهای برجسته بیوشیمی هستند. امروزه مشخص شده که الگو و اساس مولکولی باعث تنوع موجودات زنده شده است.
تمامی ارگانیسمها از باکتریها مانند اشرشیاکلی تا انسان ، از واحدهای ساختمانی یکسانی که به صورت ماکرومولکولها تجمع مییابند، تشکیل یافتهاند. انتقال اطلاعات ژنتیکی از DNA به ریبونوکلئیک اسید (RNA) و پروتئین در تمامی ارگانیسمها به صورت یکسان صورت میگیرد. آدنوزین تری فسفات (ATP) ، فرم عمومی انرژی در سیستمهای بیولوژیکی ، از راههای مشابهی در تمامی جانداران تولید میشود.
تاثیر بیوشیمی در کلینیک
مکانیسمهای مولکولی بسیاری از بیماریها ، از قبیل بیماری کم خونی و اختلالات ارثی متابولیسم ، مشخص شده است. اندازه گیری فعالیت آنزیمها در تشخیص کلینیکی ضروری میباشد. برای مثال ، سطح بعضی از آنزیمها در سرم نشانگر این است که آیا بیمار اخیرا سکته قلبی کرده است یا نه؟بررسی DNAدر تشخیص ناهنجاریهای ژنتیکی ، بیماریهای عفونی و سرطانها نقش مهمی ایفا می کند. سوشهای باکتریایی حاوی DNA نوترکیب که توسط مهندسی ژنتیک ایجاد شده است، امکان تولید پروتئینهایی مانند انسولین و هورمون رشد را فراهم کرده است. به علاوه ، بیوشیمی اساس علایم داروهای جدید خواهد بود. در کشاورزی نیز از تکنولوژی DNA نوترکیب برای تغییرات ژنتیکی روی ارگانیسمها استفاده میشود.
گسترش سریع علم و تکنولوژی بیوشیمی در سالهای اخیر ، محققین را قادر ساخته که به بسیاری از سوالات و اشکالات اساسی در مورد بیولوژی و علم پزشکی جواب بدهند. چگونه یک تخم حاصل از لقاح گامتهای نر و ماده به سلولهای عضلانی ، مغز و کبد تبدیل میشود؟ به چه صورت سلولها با همدیگر به صورت یک اندام پیچیده درمیآیند؟ چگونه رشد سلولها کنترل میشود؟ علت سرطان چیست؟ مکانیسم حافظه کدام است؟ اساس مولکولی اسکیزوفرنی چیست؟
مدلهای مولکولی ساختمان سه بعدی
وقتی ارتباط سه بعدی بیومولکولها و نقش بیولوژیکی آنها را بررسی میکنیم، سه نوع مدل اتمی برای نشان دادن ساختمان سه بعدی مورد استفاده قرار میگیرد.
مدل فضا پرکن (Space _ Filling)
این نوع مدل ، خیلی واقع بینانه و مصطلح است. اندازه و موقعیت یک اتم در مدل فضا پرکن بوسیله خصوصیات باندها و شعاع پیوندهای واندروالسی مشخص میشود. رنگ مدلهای اتم طبق قرارداد مشخص میشود.
مدل گوی و میله (ball _ and _ Stick)
این مدل به اندازه مدل فضا پرکن ، دقیق و منطقی نیست. برای اینکه اتمها به صورت کروی نشان داده شده و شعاع آنها کوچکتر از شعاع واندروالسی است.
مدل اسکلتی (Skeletal)
سادهترین مدل مورد استفاده است و تنها شبکه مولکولی را نشان میدهد و اتمها به وضوح نشان داده نمیشوند. این مدل ، برای نشان دادن ماکرومولکولهای بیولوژیکی از قبیل مولکولهای پروتئینی حاوی چندین هزار اتم مورد استفاده قرار میگیرد.
فضا
در نشان دادن ساختمان مولکولی ، بکار بردن مقیاس اهمیت زیادی دارد. واحد آنگستروم ( )، بطور معمول برای اندازهگیری طول سطح اتمی مورد استفاده قرار میگیرد. برای مثال ، طول باند C _ C ، مساوی 1،54 آنگستروم میباشد. بیومولکولهای کوچک ، از قبیل کربوهیدراتها و اسیدهای آمینه ، بطور تیپیک ، طولشان چند آنگستروم است. ماکرومولکولهای بیولوژیکی ، از قبیل پروتئینها ، 10 برابر بزرگتر هستند. برای مثال ، پروتئین حمل کننده اکسیژن در گلبولهای قرمز یا هموگلوبین ، دارای قطر 65 آنگستروم است. ماکرومولکولهای چند واحدی 10 برابر بزرگتر میباشند. ماشینهای سنتز کننده پروتئین در سلولها یا ریبوزومها ، دارای 300 آنگستروم طول هستند. طول اکثر ویروسها در محدوده 100 تا 1000 آنگستروم است. سلولها بطور طبیعی 100 برابر بزرگتر هستند و در حدود میکرومتر (μm) میباشند. برای مثال قطر گلبولهای قرمز حدود 7μm است. میکروسکوپ نوری حداقل تا 2000 آنگستروم قابل استفاده است. مثلا میتوکندری را میتوان با این میکروسکوپ مشاهده کرد. اما اطلاعات در مورد ساختمانهای بیولوژیکی از مولکولهای 1 تا
)، بطور معمول برای اندازهگیری طول سطح اتمی مورد استفاده قرار میگیرد. برای مثال ، طول باند C _ C ، مساوی 1،54 آنگستروم میباشد. بیومولکولهای کوچک ، از قبیل کربوهیدراتها و اسیدهای آمینه ، بطور تیپیک ، طولشان چند آنگستروم است. ماکرومولکولهای بیولوژیکی ، از قبیل پروتئینها ، 10 برابر بزرگتر هستند. برای مثال ، پروتئین حمل کننده اکسیژن در گلبولهای قرمز یا هموگلوبین ، دارای قطر 65 آنگستروم است. ماکرومولکولهای چند واحدی 10 برابر بزرگتر میباشند. ماشینهای سنتز کننده پروتئین در سلولها یا ریبوزومها ، دارای 300 آنگستروم طول هستند. طول اکثر ویروسها در محدوده 100 تا 1000 آنگستروم است. سلولها بطور طبیعی 100 برابر بزرگتر هستند و در حدود میکرومتر (μm) میباشند. برای مثال قطر گلبولهای قرمز حدود 7μm است. میکروسکوپ نوری حداقل تا 2000 آنگستروم قابل استفاده است. مثلا میتوکندری را میتوان با این میکروسکوپ مشاهده کرد. اما اطلاعات در مورد ساختمانهای بیولوژیکی از مولکولهای 1 تا 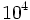 آنگستروم با استفاده از میکروسکوپ الکترونی X-ray بدست آمده است. مولکولهای حیات ثابت میباشند.
آنگستروم با استفاده از میکروسکوپ الکترونی X-ray بدست آمده است. مولکولهای حیات ثابت میباشند.
زمان لازم برای انجام واکنشهای بیوشیمیایی
راکسیونهای شیمیایی در سیستمهای بیولوژیکی به وسیله آنزیمها کاتالیز میشوند. آنزیمها سوبستراها را در مدت میلی ثانیه ( ) به محصول تبدیل میکنند. سرعت بعضی از آنزیمها حتی سریعتر نیز میباشد، مثلا کوتاهتر از چند میکروثانیه (
) به محصول تبدیل میکنند. سرعت بعضی از آنزیمها حتی سریعتر نیز میباشد، مثلا کوتاهتر از چند میکروثانیه (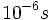 ). بسیاری از تغییرات فضایی در ماکرومولکولهای بیولوژیکی به سرعت انجام میگیرد. برای مثال ، باز شدن دو رشته هلیکسی DNA از همدیگر که برای همانندسازی و رونویسی ضروری است، یک میکروثانیه طول میکشد. جابجایی یک واحد (Domain) از پروتئین با حفظ واحد دیگر ، تنها در چند نانوثانیه (
). بسیاری از تغییرات فضایی در ماکرومولکولهای بیولوژیکی به سرعت انجام میگیرد. برای مثال ، باز شدن دو رشته هلیکسی DNA از همدیگر که برای همانندسازی و رونویسی ضروری است، یک میکروثانیه طول میکشد. جابجایی یک واحد (Domain) از پروتئین با حفظ واحد دیگر ، تنها در چند نانوثانیه (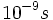 ) اتفاق میافتد. بسیاری از پیوندهای غیر کووالان مابین گروههای مختلف ماکرومولکولی در عرض چند نانوثانیه تشکیل و شکسته میشوند. حتی واکنشهای خیلی سریع و غیر قابل اندازه گیری نیز وجود دارد. مشخص شده است که اولین واکنش در عمل دیدن ، تغییر در ساختمان ترکیبات جذب کننده فوتون به نام رودوپسین میباشد که در عرض
) اتفاق میافتد. بسیاری از پیوندهای غیر کووالان مابین گروههای مختلف ماکرومولکولی در عرض چند نانوثانیه تشکیل و شکسته میشوند. حتی واکنشهای خیلی سریع و غیر قابل اندازه گیری نیز وجود دارد. مشخص شده است که اولین واکنش در عمل دیدن ، تغییر در ساختمان ترکیبات جذب کننده فوتون به نام رودوپسین میباشد که در عرض 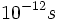 اتفاق میافتد.
اتفاق میافتد.
انرژی
ما بایستی تغییرات انرژی را به حوادث مولکولی ربط دهیم. منبع انرژی برای حیات ، خورشید است. برای مثال ، انرژی فوتون سبز ، حدود 57 کیلوکالری بر مول (Kcal/mol) بوده و ATP ، فرمول عمومی انرژی ، دارای انرژی قابل استفاده به اندازه 12 کیلوکالری بر مول میباشد. برعکس ، انرژی متوسط هر ارتعاش آزاد در یک مولکول ، خیلی کم و در حدود 0،6 کیلوکالری بر مول در 25 درجه سانتیگراد میباشد. این مقدار انرژی ، خیلی کمتر از آن است که برای تجزیه پیوندهای کووالانسی مورد نیاز است، (برای مثال 83Kcal/mol برای پیوند C _ C). بدین خاطر ، شبکه کووالانسی بیومولکولها در غیاب آنزیمها و انرژی پایدار میباشد. از طرف دیگر ، پیوندهای غیر کووالانسی در سیستمهای بیولوژیکی بطور تیپیک دارای چند کیلوکالری انرژی در هر مول میباشند. بنابراین انرژی حرارتی برای ساختن و شکستن آنها کافی است. یک واحد جایگزین در انرژی ، ژول میباشد که برابر 0،239 کالری است.
ارتباطات قابل بازگشت بیومولکولها
ارتباطات قابل برگشت بیومولکولها از سه نوع پیوند غیر کووالانسی تشکیل شده است. ارتباطات قابل برگشت مولکولی ، مرکز تحرک و جنبش موجود زنده است. نیروهای ضعیف و غیر کووالان نقش کلیدی در رونویسی DNA ، تشکیل ساختمان سه بعدی پروتئینها ، تشخیص اختصاصی سوبستراها بوسیله آنزیمها و کشف مولکولهای سیگنال ایفا میکنند. به علاوه ، اکثر مولکولهای بیولوژیکی و پروسههای درون مولکولی ، بستگی به پیوندهای غیر کووالانی همانند پیوندهای کووالانی دارند. سه پیوند اصلی غیر کووالان عبارت است از: پیوندهای الکترواستاتیک ، پیوندهای هیدروژنی و پیوندهای واندروالسی آنها از نظر ژئومتری ، قدرت و اختصاصی بودن با هم تفاوت دارند. علاوه از آن ، این پیوندها به مقدار زیادی از طرق مختلف در محلولها تحت تاثیر قرار میگیرند.

با سلام . به وبگاه رسمی علم و دانش خوش آمدید ! من شایان شیت ره هستم دانش آموز دبیرستان سلام صادقیه ! این پروژه تحقیقی بنده است . تا این جا 77 مطلب ثبت گردیده . امید وارم از این مطالب نهایت استفاده رو ببرید . با تشکر مدیریت !
بازدید دیروز : 1
کل بازدید : 46046
کل یاداشته ها : 77