واکنش های آلکیل هالید
?-هیدرولیز
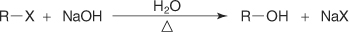
?-سنتز ویلیامسون

?-نیتریلاسیون
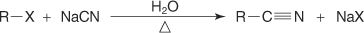
?-آمیناسیون آلکیل هالید
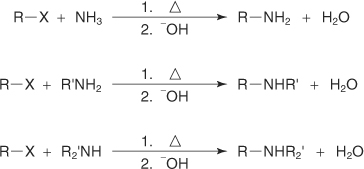
?-آلکن: حذف بتا
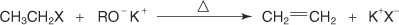
?-واکنش با معرف گرینیارد

یک مول از هر ذره ( اتم ، مولکول یا یون ) به تعداد عدد آووگادرو از آن ذره است. یعنی یک ذره مثلا یک مول اتم کربن به اندازه 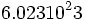 اتم کربن دارد که این مقدار اتم در کنار هم یک مول را ایجاد میکنند. اتم کربن دارد که این مقدار اتم در کنار هم یک مول را ایجاد میکنند. |
ریشه لغوی
عدد 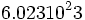 را به یاد دانشمند پر آوازه ایتالیایی "آمدئو آووگادرو" ، عدد آووگادرو نامیدند که این عدد ، تعداد ذرههای موجود در یک مول از یک ماده است.
را به یاد دانشمند پر آوازه ایتالیایی "آمدئو آووگادرو" ، عدد آووگادرو نامیدند که این عدد ، تعداد ذرههای موجود در یک مول از یک ماده است.
اتم گرم
از آنجائیکه اتمها ذراتی بسیار کوچکند و جرم بسیار کمی دارند، یکاهای معمولی مانند گرم برای اندازه گیری جرم آنها بسیار بزرگ است. بنابراین اندازه گیری جرم یکی از آنها با ابزارهای معمولی ، کاری غیر ممکن است. به این علت ، همواره به جای جرم یک اتم ، جرم تعدادی از آنها را که شامل 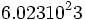 تعداد است در نظر میگیرند که جرم این تعداد از ذره را مبنای کار خود قرار میدهند که قابل اندازه گیری با ترازو است که میتوان برای مقاصد عملی چه در آزمایشگاه و چه در کارخانه بکار برد.
تعداد است در نظر میگیرند که جرم این تعداد از ذره را مبنای کار خود قرار میدهند که قابل اندازه گیری با ترازو است که میتوان برای مقاصد عملی چه در آزمایشگاه و چه در کارخانه بکار برد.
شیمیدانها جرم یک مول یا 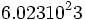 اتم را اتم گرم مینامند.
اتم را اتم گرم مینامند.
کاربرد عدد آووگادرو
برای بیان مفهوم اتم گرم
شیمیدانها جرم یک مول یا 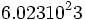 اتم را اتم گرم میگویند و آنرا برحسب گرم بیان میکنند. برای مثال اتم اکسیژن ، 16 گرم و اتم کربن ، 12 گرم است؛ یعنی جرم یک مول از اتمهای اکسیژن که شامل
اتم را اتم گرم میگویند و آنرا برحسب گرم بیان میکنند. برای مثال اتم اکسیژن ، 16 گرم و اتم کربن ، 12 گرم است؛ یعنی جرم یک مول از اتمهای اکسیژن که شامل 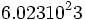 اتم است، برابر 16 گرم و به همین ترتیب ، جرم یک مول از اتمهای کربن برابر 12 گرم است.
اتم است، برابر 16 گرم و به همین ترتیب ، جرم یک مول از اتمهای کربن برابر 12 گرم است.
مفهوم مولکول گرم
بدیهی است جرم یک مول از مولکولهای یک ماده که «مولکول گرم» نامیده میشود. به کمک اتم گرم اتمهای سازنده آن به آسانی قابل محاسبه است. برای مثال ، مولکول گرم اکسیژن 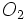 برابر مجموع دو اتم اکسیژن
برابر مجموع دو اتم اکسیژن 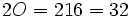 گرم و مولکول گرم
گرم و مولکول گرم 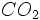 برابر است با مجموع دو اتم اکسیژن و یک اتم کربن
برابر است با مجموع دو اتم اکسیژن و یک اتم کربن  گرم است.
گرم است.
مفهوم وزن مولکولی
شمار اجزای یک مول برابر با عدد آووگادرو است. تعداد مولکولهای موجود در یک مول از یک ترکیب مولکولی ، برابر با عدد آووگادرو است و جرم آن بر حسب گرم برابر با وزن مولکولی آن ترکیب است. برای مثال ، وزن مولکولی 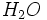 برابر با 18.02 است. در نتیجه داریم:
برابر با 18.02 است. در نتیجه داریم:
مولکول 
چون یک مولکول آب دارای یک اتم O است یک مولکول 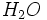 شامل دو اتم از اتم H و یک مولکول از اتم O است.
شامل دو اتم از اتم H و یک مولکول از اتم O است.

| مقدار خالصی که شامل عدد آووگادرو ، واحد اصلی باشد، یک مول نامیده میشود که یک واحد اصلی است. مول مقدار ماده خالصی است که تعداد واحدهای مستقل اصلی آن ، دقیقا برابر با تعداد اتمهای 12g کربن 126C باشد. پس نمونهای از یک عنصر که جرم آن بر حسب گرم از لحاظ عددی برابر با وزن اتمی آن عنصر باشد، شامل یک مول از اتمهای آن عنصر ، یعنی شامل عدد آووگادرو اتم است. مثلا وزن اتمی بریلیم ، 9.01218است. بنابر این: اتم بریلیم Be=1mol Be = 6.02205x1023 : 9.01218 |
اطلاعات اولیه
چون وزن اتمی فلوئور 19.0 و وزن اتمی هیدروژن 1.0 است، سنگینی یک اتم فلوئور ، 19 برابر یک اتم هیدروژن خواهد بود. حال اگر 100 اتم فلوئور و 100 اتم هیدروژن را در نظر بگیریم، جرم مجموع اتمهای فلوئور 19 برابر جرم اتمهای هیدروژن میشود. پس جرمهای هر دو نمونهای از فلوئور و هیدروژن که عمده اتمهای آنها برابر باشد همان نسبت 19.0 به 1.0 یعنی نسبت وزنهای اتمی آنها ، خواهد بود.
اگر 19.0g فلوئور و 1.0g هیدروژن داشته باشیم، این دو مقدار بر حسب گرم و از لحاظ عددی برابر وزنهای اتمی این دو عنصر است. چون جرمهای این دو نمونه نسبت 19.0 به 1.0 دارد، نمونهها باید شامل تعداد اتمهای مساوی باشند. در واقع ، نمونهای از هر عنصر که جرم آن بر حسب گرم عددی برابر با وزن اتمی آن عنصر باشد، شامل این عده اتمهای یکسان خواهد بود.
این عدد را به افتخار "آمدو آووگادرو" ، عدد آووگادرو مینامند. آووگادرو نخستین کسی بود که رفتار گازها در واکنش شیمیایی را بر حسب عده مولکولها واکنش دهنده ، توضیح داد. مقدار عدد آووگادرو با آزمایش معین شده و تا شش رقم با معنی عبارت است از:
مول ماده مولکولی
یک مول ، مرکب از عدد آووگادرو واحد مستقل است. یک مول ماده مولکولی مرکب از عدد آووگادرو مولکول و جرمی بر حسب گرم دارد که از لحاظ عددی برابر با وزن مولکولی آن ماده است. مثلا وزن مولکولی H2O برابر 18.02 گرم است، پس مولکول H2O با:
چون یک مولکول آب ، دو اتم H و یک اتم O دارد، یک مول H2O شامل دو اتم H و یک مول اتم O است. با استفاده از تعریف مول ، نوع واحد مستقلی که اندازه گیری میشود، باید مشخص باشد. یک مول از اتمهای H شامل: 6.02205x1023 اتم H و جرم آن ، تا سه رقم با معنی ، 1.01g است، یک مول از مولکولهای H2 شامل 6.02205xa023 مولکول H2 و جرم آن 2.02g است. برای فلوئور :

مول در مواد یونی
وقتی میگوییم یک مول(BaCl2) ، به این معنی است که نمونه مورد نظر ما شامل عدد آووگادرو واحد فرمولی است که واحد مستقل آن مشخص است. یک مول BaCl2 جرمی برابر 208.3g دارد که همان وزن فرمولی BaCl2 است. در واقع ، یک مول BaCl2 شامل باریم:
نگاه کلی
مولاریته یا غلظت مولار که با (M) نشان داده میشود، عبارت است از تعداد وزن مولکول گرم (یا تعداد مول) از یک جسم حل شده در یک لیتر محلول. مول کمیت اساسی است که یک شیمیدان تجزیه با آن سر و کار زیادی دارند. یک مول برابر با 6.023X1023 مولکول از یک جسم است. اصطلاح مول در یک مفهوم وسیع برای توصیف مقادیر ترکیبات مولکولی ، عناصر آزاد و یونها بکار میرود. به بیان دیگر وزن تعداد 6.023X1023 عدد مولکول ، یون یا عنصر برابر با 1 مول مولکول ، یون یا عنصر است که به صورت مولکول گرم ، یون گرم یا عنصر گرم نامیده میشود.
تهیه محلولهای مولار
برای تهیه یک محلول مولار از یک ترکیب باید یک مول از آن را وزن کرده و به مقدار کافی به آن آب اضافه کنیم تا دقیقا یک لیتر محلول بدست آید. به عنوان مثال برای تهیه یک محلول 2M از اسید سولفوریک باید گرم 196.16=98.08×2 از اسید سولفوریک را در مقدار کافی آب حل کنیم تا یک لیتر محلول 2M اسید سولفوریک بدست آید. وقتی یک محلول مایع تهیه میکنیم، حجم محلول به ندرت مساوی مجموع حجمهای اجزا خالص سازنده آن است. معمولا حجم نهایی محلول بیشتر یا کمتر از مجموع حجمهای اجزا سازنده آن است.
از این رو برای تهیه یک محلول معین عملا نمیتوانیم مقدار حلال لازم را پیشبینی کنیم. برای تهیه محلولهای مولار و سایر محلولهایی که بر اساس حجم کل است، معمولا از بالنهای حجمسنجی استفاده میشود. در این صورت برای تهیه یک محلول مقدار دقیق ماده حل شونده را در بالن جای میهیم و با دقت آن قدر آب میافزائیم و بطور مداوم و با احتیاط هم میزنیم تا سطح محلول به خط نشانهای که روی گردن بالن مشخص شده برسد.
محاسبه غلظت یک محلول بر حسب مولاریته
برای محاسبه غلظت یک محلول بر حسب مولاریته ابتدا باید تعداد مولهای جسم حل شده را بدست آوریم. تعداد مولهای جسم حل شده از تقسیم کردن وزن آن (برحسب گرم) به وزن فرمولی بدست میآید.
- اگر ماده حل شده به صورت مولکولی باشد، در آن صورت تعداد مول از فرمول وزن مولکولی/گرمهای ماده حل شده=تعداد مولها (مولکول حل شده) محاسبه میشود.
- اگر بخواهیم تعداد مولهای یک یون را محاسبه کنیم، باید بجای وزن مولکولی وزن یون مربوطه را در فرمول قرار دهیم. یعنی وزن یونی/گرمهای ماده حل شده=تعداد مولها (یون حل شده).
- اگر ماده حل شده به صورت اتمی باشد، مثلا نقره فلزی در آن صورت تعداد مولها از فرمول وزن اتمی/گرمهای ماده حل شده = تعداد مولها (اتم حل شده) بدست میآید. بعد از بدست آوردن تعداد مولهای ماده حل شده با قرار دادن آن در فرمول غلظت مولار ، مولاریته محلول بدست میآید. یعنی داریم
یا
وقتی غلظت محلول بر حسب مولاریته بیان میشود، محاسبه مقدار ماده حل شده موجود در یک نمونه معین از محلول آسان است. به عنوان مثال یک لیتر محلول 2 مولار دارای 2 مول ماده حل شده است. 500ml آن دارای یک مول ماده حل شده ، 100ml آن دارای 0.2 مول ماده حل شده است.
نکته مهم
تنها اشکال تعیین غلظتها بر اساس حجم محلول این است که چنین غلظتهایی با تغییر دما اندکی تغییر میکنند، زیرا تغییر دما موجب انقباض یا انبساط محلول میشود. بنابراین برای اینکه غلظت محلول تهیه شده دقیقتر باشد، باید محلول در دمایی که قرار است استفاده شود، تهیه شده و از بالن حجم سنجی که در این دما مدرج شده است استفاده شود.
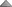

| تجزیه ای که بر سنجش دقیق حجم یک محلول ، استوار است، تجزیه حجم سنجی نامند. |
تیتراسیون
در تجزیه حجم سنجی ، طرز کاری موسوم به تیتراسیون مورد استفاده قرار میگیرد.
محلول استاندارد و شناساگر
در یکی از انواع تیتراسیون ، محلولی با غلظت معین که محلول استاندارد خوانده میشود، به حجم معینی از محلولی که غلظت آن معین نیست، ولی با محلول استاندارد ترکیب میشود، اضافه میکنند. محلول استاندارد را در لوله شیشه ای مدرجی که بورت نامیده میشود، قرار میدهند. در انتهای پایینی بورت ، شیری تعبیه شده است که ریختن مقادیر کنترل شده ای از محلول استاندارد را به درون ظرف حاوی محلول با غلظت نامعلوم اماکنپذیر میسازد.
حجم معینی از محلول با غلظت نامعلوم را یا وزن معینی از ماده جامدی که خلوص آن معلوم نیست و در آب حل شده است، در یک ارلن میریزیم و چند قطره از ماده ای که به شناساگر موسوم است، به آن اضافه میکنیم.
نقطه همارزی
طی عمل افزایش ، ارلن را با چرخاندن به هم می زنیم تا کاملا محتوی ، یکدست شود. نقطه هم ارزی در نقطه پایانی که با تغییر رنگ شناساگر مشخص میشود، از دو واکنشگر ( یعنی محلول استاندارد و ماده درون ارلن ) مقادیر هم ارز وارد واکنش شده است. حجم محلول استاندارد مصرف شده از بورت خوانده میشود.

برخی دیگر از انواع تیتراسیون
در برخی دیگر از انواع تیتراسیون ، حجم معینی از محلول استانداردبا وزن معینی از ماده با خلوص معین که در آب حل شده است، در ارلن قرار داده میشود. سپس محلول نامعلوم از بورت به ارلن افزوده میشود تانقطه همارزی بدست آید.
انواع تجزیه حجم سنجی
سه نوع متداول تجزیه حجم سنجی عبارتند از:
- واکنشهای تراسبی
- خنثی شدن اسید و باز
- واکنشهای اکسایش-کاهش

با سلام . به وبگاه رسمی علم و دانش خوش آمدید ! من شایان شیت ره هستم دانش آموز دبیرستان سلام صادقیه ! این پروژه تحقیقی بنده است . تا این جا 77 مطلب ثبت گردیده . امید وارم از این مطالب نهایت استفاده رو ببرید . با تشکر مدیریت !
بازدید دیروز : 2
کل بازدید : 46163
کل یاداشته ها : 77