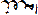تاریخچه
این مولد شیمیای توسط ولتا (A. Volta) فیزکدان ایتالیایی ساخته شد. ولتا ثابت کرد که وقتی رساناهای مختلفی را باهم تماس دهیم، جدایی بارهای الکتریکی (بروز emf) پدید میآید. در نتیجه تماس در سطح مرزی بارهای منفی روی یک فلز جمع میشوند (فزونی الکترون) و روی فلز دیگر بارهای مثبت ظاهر میشوند (کمبود الکترون).
اولین مولد emf
اولین مولد نیروی محرکه الکتریکی emf که امکان مطالعه جریان الکتریکی را فراهم آورد و برای مقاصد عملی بکار رفت پیل گالوانی بود که در آن انرژی آزاد شده با عبور جریان از مدار را انرژی آزاد شده از واکنشهای شیمیایی تأمین میکنند، که با عمل پیل همراه هستند.
پیل گالوانی
پیل گالوانی به احترام گالوانی (L. Galvani) فیزیکدان و متخصص علم تشریح ایتالیایی که آزمایشهای او محرک بررسیهای ولتا بود، نام گذاری شده است. پدیده کشف شده توسط گالوانی و ولتا که عبارت بود از جدایی بار یعنی بروز emf در سطح مشترک بین دو رسانا که در ساختن پیل گالوانی بکار گرفته شد.
قاعده ولتا
- در مداری که دارای تعداد دلخواهی از فلزات مختلف باشد emf برابر صفر است.
- در فلزات بر اثر عبور جریان هیچ تغییر شیمیایی رخ نمیدهد.
- در مدار بستهای که توسط رساناهای فلزی تشکیل میشود جمع جبری تمام emf ها برابر صفر است (پیش بینی با قانون بقای انرژی).
پیل ولتا
ولتا دنبال ایدهای بود که جریان الکتریکی مدار را مقداری تغییر دهد. به عبارتی با ایجاد تغییر در ترکیب شیمیای رسانا در اثر عبور جریان به تعدادی تحولات شیمیای منجر میشود و در نتیجه آنها انرژی داخلی (انرژی شیمیایی) اجسام تشکیل دهنده کاهش مییابد و با صرف این کاهش انرژی جریان میتواند در مدار باقی بماند.
برای حصول به این نتیجه ولتا با فرو بردن یک تیغه مس و یک تیغه روی در محلول اسید سولفوریک به اولین پیل گالوانی که به پیل ولتا معروف است واقعیت بخشید (برای اینکه پیل نهایی حاصل تلاشهای گالوانی و ولتا بود به آن پیل گالوانی ولتا گویند). با اتصال تیغههای مس و روی (الکترودها) پیل ولتا با رسانا (مثلا یک سیم فلزی) در این مدار بسته جریان الکتریکی بوجود میآید.
ساختمان پیل ولتا
پیل ولتا شامل تمام اجزائی است که برای هر پیل گالوانی لازم است. یعنی دو رسانای فلزی (روی و مس) که با رسانای دیگر (محلول اسید سولفوریک)در تماس است. با این حال پیل مناسبی نیست زیرا emf آن که در شروع کار به 107v میرسد، به سرعت افت میکند. به این دلیل معمولا از پیلهای دیگری استفاده میشود که در انتخاب رساناهای فلزی و محلول رسانا با پیل ولتا متفاوت هستند.


مقدمه
هنگامی که چراغ قوه را روشن کنید یا برای روشن شدن خودرو استارت میزنید از انرژی الکترکی استفاده میکنید. این انرژی توسط دستهای از واکنشهای شیمیایی فراهم میشود که در باتریها روی میدهد. مطالعه شیمی باتریها و مباحثی برقکافت ، آبکاری ، فلز گری و از همه مهمتر خوردگی که در چالش برانگیزترین مسأله در جوامع صنعتی امروز به شمار میآید همگی در نتیجه واکنشهای الکتروشیمیای مطرح میشوند.
 |
تاریخچه
الکساندر ولتا (1827 - 1745) فیزیکدان ایتالیایی و مخترع اولین باتری است که اکنون پیل ولتا نامیده میشود. این پیل شامل صفحات متناوبی از مس و روی است که توسط صفحات مقوایی نازک که در محلول نمکی غوطهورند از هم جدا شدهاند، بخاطر کمک او به علم الکتریسیته ، واحد اختلاف پتانسیل الکتریکی (ولت) به نام اوست.
نقش و تأثیر در زندگی
باتریهای خشک در زندگی روزمره برای مصارف گوناگون بکار میروند، سلولهای انبارهای که شامل باتری خودرو باشند برای راه اندازی اتومبیلها بکار میروند، از باتریهای نیکل - کادمیم در ابزاری مانند تلفن بی سیم ، رایانههای قابل حمل (لپ تاپ) ، تلفن همراه و ماشینهای اصلاح استفاده میشود و سلولهای سوختی برای تأمین برق و آب آشامدنی فضاپیما استفاده میشود و برای تأمین برق بیمارستانها و به تازگی تأمین نیروی محرکه وسایل نقلیه سنگین و سبک هم استفاده میشود. خوردگی سالانه خسارات زیادی در صنعت به بار میآورد.
ساختار یا ساختمان
یک پیل الکتروشیمیایی از دو الکترود جریان به نام الکترود کاتد و آند تشکیل یافته است، به هر یک از این الکترودها که در محلول الکترولیت قرار گرفتهاند و محلولهای الکترولیتی در صورت متفاوت بودن از نظر ترکیب شیمیایی توسط یک پیل نمی که لولههای شیشهای نعلی شکل پر شده از محلول غلیظ یک الکترولیت قدیمی باشند و یا یک دیواره متخلخل (نظیر شیشه گداخته و یا چینی و سرامیک بدون لعاب) باهم ارتباط دارند. پیهای الکتروشیمیایی بطور قرار دادی به دو نوع پیل گالوانیک (ولتایی) و الکترولیزی تقسیم میشوند.
 |
طرز کار و مکانیزم کار
پیلهای الکتروشیمیایی با واکنشهای اکسایش - کاهش: واکنشهای اکسایش- کاهش عبارتند از انتقال الکترون از یک واکنشگر به واکنشگر دیگری. واکنش اکسایش - کاهش از دو نیم واکنش تشکیل یافته است، نیم واکنشی که در آن واکنشگر الکترون از دست میدهد نیم واکنش اکسید است و در آند رخ میدهد و واکنشگر را کاهنده یا احیا کننده پیلهای الکتروشیمیایی مینامند. نیم واکنشی که در آن واکنشگر الکترون میگردد، نیم واکنش احیا یا کاهش میباشد و در کاتد رخ میدهد و واکنشگر را اکسید کننده یا اکسنده مینامند و پتانسیل واکنش را میتوان با استفاده از معادله ارنست محاسبه کرد.
کاربردها
از پیلهای الکتروشیمیایی میتوان در موارد زیر استفاده نمود:
- تعیین PH محیط واکنش و ثابت تعادل واکنش
- در صنعت نانو برای رسوب گیری مواد بر روی الکترودها
- در ساخت و کاربرد حسگرها مورد استفاده در تشخیص و اندازه گیری گونههای زیستی یعنی زیست حسگرها
- در صنعت پزشکی برای رسم الکتروکار دیاگرام
چشم انداز و آینده بحث
مواد قابل سنجش متعددی در هوا ، آب ، خاک و دیگر تشکیل دهندههای محیط زیست وجود دارد و هر روز بر تعداد اینگونه مواد افزوده میشود. ضرورت اندازه گیری آلایندههایی نظیر انواع حشره کشها ، کودهای شیمیایی ، زبالهها و پسابهای صنعتی و خانگی بر کسی پوشیده نیست. با استفاده از پیلها و اندازه گیری پتانسیل آنها به ویژه زیست حسگرها میتوان کلیه امور را در مدت زمان کم و به آسانی انجام داد.



دید کلی
ساخت و مصرف چسب از گذشته رایج بوده است. در قدیم ، از موادی چون قیر و صمغ درختان به عنوان چسب استفاده میکردند. در تمام قرون گذشته و همچنین قرن نوزدهم چسبها منشاء حیوانی و یا گیاهی داشتهاند. چسبهای حیوانی بطور عمده بر مبنای کلوژن مامالیام Mammaliamبودند که پروتئین اصلی پوست ، استخوان و رگ و پی است و چسبهای گیاهی از نشاسته و دکسترین دانههای گندم ، سیب زمینی و برنج تهیه میشدند.
کاربردهای متنوع چسب
از قرن نوزدهم بتدریج با پیدایش چسبهای سنتتیک ساخته شده در صنعت پلیمر ، چسبهای سنتی و گیاهی و حیوانی از صحنه خارج شده است. صنعت چسب به صورت گسترده ای در حال رشد میباشد و تعداد محدودی وسایل مدرن ساخت بشر وجود دارد که از چسب در آنها استفاده نشده است. در اتصالات اغلب وسایل از یک جعبه بسیار ساده غلات گرفته تا هواپیمای پیشرفته بوئینگ 747 از چسب استفاده شده است.
امکانات بشر میتواند بوسیله چسبها اصلاح گردد. این مطلب ، شامل استفاده از سیمانهای سخت شده توسط UV در دندانپزشکی و سیمانهای پیوند آکلریلیک در جراحی استخوان میباشد. پیشرفت جدیدی که اخیرا در کاربرد چسب حاصل گشت، اتصال ریلهای فولادی و تراموای جدید شهر منچستر بود. چسبها نه تنها برای موادی که بایستی چسبانده و بهم پیوسته شوند، بلکه در ایجاد چسبندگی برای موادی از قبیل جوهر تحریر ، رنگها و سایر سطوح پوششی ، وسایل بتونه کاری و وجوه میانی در مواد ترکیبی از قبیل فولاد یا بافت پارچه ، در تایرهای لاستیکی و شیشه یا الیاف در پلاستیکها ضروری هستند.
اجزای تشکیل دهنده چسبها
مواد پلیمری
چسبها ، همگی حاوی پلیمر هستند یا پلیمرها در حین سخت شدن چسبها بوسیله واکنش شیمیایی پلیمر شدن افزایشی یا پلیمر شدن تراکمی حاصل میشوند. پلیمرها به چسبها قدرت چسبندگی میدهند. میتوان آنها را به صورت رشتههایی از واحدهای شیمیایی همانند که بوسیله پیوند کووالانسی به هم متصل شدهاند، در نظر گرفت.
پلیمرها در دماهای بالا روان میگردند و در حلالهای مناسب حل میگردند. خاصیت روان شدن آنها در چسبهای حرارتی و خاصیت حل شوندگی آنها در چسبهای بر پایه حلال ، یک امر اساسی میباشد. پلیمرهای شبکهای در صورت گرم شدن جریان نمییابند، ممکن است در حلالها متورم گردند، ولی حل نمیشوند. تمامی چسبهای ساختمانی ، شبکهای هستند، زیرا این مورد خزش (تغییر شکل تحت بار ثابت) از بین میبرد.
افزودنیهای دیگر
بسیاری از چسبها ، علاوه بر مواد پلیمری دارای افزودنیهایی هستند از قبیل:
- مواد پایدار کننده در برابر تخریب توسط اکسیژن و UV.
- مواد نرم کننده که قابلیت انعظاف را افزایش میدهد و دمای تبدیل شیشهای (Tg ) را کاهش میدهد.
- مواد پر کننده معدنی که میزان انقباض در سخت شدن را کاهش میدهد و خواص روان شدن را قبل از سخت شدن تغییر میدهد و خواص مکانیکی نهایی را بهبود میبخشد.
- مواد تغلیظ کننده.
- معرف های جفت کننده سیلانی.
تئوریهای چسبندگی
درباره چسبندگی شش تئوری وجود دارد که عبارتند از:
تئوری جذب فیزیکی
جذب فیزیکی شامل نیروهای واندروالسی در بین سطوح میباشد که در بر گیرنده جاذبههای بین دو قطبیهای دائم و دو قطبی القایی و نیروهای لاندن میباشد.
تئوری جذب شیمیایی
تئوری پیوند شیمیایی در مورد چسبندگی ، بر اساس تشکیل پیوندهای کووالانسی ، یونی و هیدروژنی بین سطح میباشد. مدارکی مبنی بر اینکه پیوندهای کووالانسی با عوامل جفت کنندگی سیلانی تشکیل میشود، وجود دارد و ممکن است که چسبها شامل گروههای هیدروکسی یا آمین باشند که با اتمهای هیدروژن فعال از قبیل گروههای هیدروکسیل ، اگر چوب یا کاغذ اجزا مورد عمل باشند، پیوند هیدروژنی ایجاد میکنند.
تئوری نفوذ
تئوری نفوذ این دیدگاه را مطرح میکند که پلیمرها هنگام تماس ممکن است در همدیگر نفوذ کنند. بنابراین مرز درونی سرانجام برداشته میشود و نفوذ پلیمرها در صورتی اتفاق میافتد که زنجیرهای متحرک و سازگار باشند. به عبارت دیگر ، دما باید از دمای تبدیل شیشهای بالاتر رود.
تئوری الکتروستاتیک
تئوری الکتروستاتیک ، از این طرح سرچشمه گرفته است که وقتی دو فلز در تماس با یکدیگر باشند، الکترونها از یکی به دیگری منتقل میشوند و بنابراین یک لایه مضاعف الکتریکی تشکیل میگردد که نیروی جذب را نشان میدهد. چون پلیمرها ، نارسانا هستند، مشکل به نظر میرسد که این تئوری برای چسبها کاربرد داشته باشد.
تئوری پیوند درونی مکانیکی
اگر سطحی را که میخواهیم روی آن چیزی بچسبانیم، دارای سطحی نامنظم باشد آنگاه ممکن است چسب در ناهمواریهای سطح ، قبل از سخت شدن داخل شود. این ایده ، باعث ظهور این تئوری شد که به اتصالات چسب با مواد متخلخل از قبیل چوب و نسوجات بسط داده شد. مثالی از این قبیل ، عبارت از استفاده از اتو در لایه چسب و در لباس میباشد. لایه چسبها ، حاوی چسبهای ذوبی هستند که پس از ذوب در پارچه نفوذ میکنند.
تئوری لایه مرزی ضعیف
تئوری لایه مرزی ضعیف ، پیشنهاد میکند که سطوح تمیز ، پیوندهای قویتری با چسب ایجاد میکنند. اما برخی آلودگیها از قبیل زنگ و روغن یا گریسها ، لایه ای ایجاد میکنند که چسبندگی ضعیفی دارد. همه آلودگیها ، لایه مرزی ضعیف تشکیل نمیدهند، زیرا در برخی حالات ، آنها توسط چسب حل خواهند شد. در این محدوده ، چسبهای ساختمانی آکریلیک ، برتر از اپوکسیدها هستند و این ، بدلیل توانایی آنها برای حل کردن روغنها و گریسها میباشد.

آماده سازی سطح برای چسبندگی
آماده سازی نامناسب یا نادرست سطح ، احتمالا دلیل عمده شکسته شدن اتصالات چسبی میباشد. آماده سازی سطح یک جسم با روشهای زیر انجام میگیرد: روش های سائیدگی ، استفاده از حلالها ، تخلیه شعله وکرونا ، حک کردن تفلون ، حک کردن فلزات ، آندی کردن فلزات ، استفاده از چند سازه ها.
انواع چسبها
چسبهایی که توسط واکنش شیمیایی سخت میشوند
- چسبهای اپوکسیدی:
اپوکسیدها ، بهترین نوع چسبهای شناخته شده ساختمانی هستند و بیشترین کاربرد را دارند. رزین اپوکسی که اغلب در حالت معمول استفاده میشود، معمولا دی گیلیسریل اتراز بیس فنل DGEBA)A) نامیده میشود و بوسیله واکنش نمک سدیم از بیس فنل A با اپی کلروهیدرین ساخته میشود. آمینهای آروماتیک و آلیفاتیک به عنوان عامل سخت کننده استفاده میشوند. این چسبها به چوب ، فلزات ، شیشه ، بتن ، سرامیکها و پلاستیکهای سخت بخوبی میچسبند و در مقابل روغنها ، آب ، اسیدهای رقیق ، بازها و اکثر حلالها مقاوم هستند. بنابراین کاربرد بیشتری در چسباندن کفپوشهای وینیلی در سرویسها و مکانهای خیس و به سطوح فلزی دارند.
- چسبهای فنولیک برای فلزات:
وقتی که فنل با مقدار اضافی فرمالدئید تحت شرایط بازی در محلول آبی واکنش کند، محصول که تحت عنوان رزول شناخته شده و الیگومری شامل فنلهای پلدار شده توسط اتروگرومتیلن روی حلقههای بنزن میباشد، بدست میآید. برای جلوگیری از تشکیل حفرههای پر شده از بخار ، اتصالات چسبهای فنولیک تحت فشار ، معمولا بین صفحات پهن فولادی گرم شده توسط پرس هیدرولیک سخت میشوند. بدلیل شکننده بودن فنولیکها ، پلیمرهایی از جمله پلی وینیل فرمال ، پلی وینیل بوتیرال ، اپوکسیدها و لاستیک نیتریل اضافه میشود تا سختتر گردند.
- چسبهای تراکمی فرمالدئید برای چوب:
تعدادی از چسبهای مورد استفاده برای چوب نتیجه تراکم فرمالدئید با فنول و رزوسینول (1و3 دی هیدروکسی بنزن) هستند. بقیه با اوره یا ملامین متراکم میشوند.
- چسبهای آکریلیک:
چسبهای ساختاری شامل منومرهای آکریلیک توسط افزایشی رادیکال آزاد در دمای محیط سخت میشوند. منومر اصلی ، متیل متاکریلات (MMA) میباشد، اما موارد دیگری از قبیل اسید متاکریلات برای بهبود چسبندگی به فلزات بوسیله تشکیل نمکهای کربوکسیلات و بهبود مقاومت گرمایی و اتیلن گلیکول دی متیل اکریلات برای شبکهای کردن نیز ممکن است مورد استفاده قرار گیرد.
کلروسولفونات پلی اتیلن ، یک عامل سخت کننده لاستیک است و کیومن هیدورپراکساید و N,N دی متیلن آنیلین ، اجزاء یک آغازگر اکسایشی- کاهشی هستند. پیوند دهنده هایی که برای اتصالات محکم مصنوعی به استخوانهای انسان و پوششهای چینی برای دندانها استفاده میشود نیز بر مبنای MMA هستند و بطورکلی برای جسباندن فلزات ، سرامیکها ، بیشتر پلاستیکها و لاستیکها استفاده میشود و اتصالات پرقدرتی را ایجاد میکنند.
- چسبهای غیر هوازی:
چسبهای غیر هوازی در غیاب اکسیژن که یک بازدارنده پلیمر شدن است، سخت میگردد. این چسبها اغلب بر پایه دی متاکریلاتهایی از پلی اتیلن گلیکول هستند. کاربرد این چسبها ، اغلب در محل اتصال چرخ دنده ها ، تقویت اتصالات استوانهای و برای دزدگیری میباشد. - چسب های پلی سولفیدی:
پلی سولفیدها در ابتدا به عنوان دزدگیر استفاده میشدند و یک کاربرد مهم دزدگیری لبههای آینههای دوبل میباشد. هر دو برای اینکه واحدها را باهم نگه دارند و مانعی در برابر نفوذ رطوبت ایجاد کنند. آنها به وسیله بیس (2- کلرواتیل فرمال) با سدیم پلی سولفید تهیه میشوند و به منظور کاهش قیمت از پرکننده های معدنی استفاده میشود. به عنوان نرم کننده ، از فتالاتها و معرفهای جفت کننده سیلانی استفاده میشود و عامل سخت کننده آنها شامل دی اکسید منگنز و کرومات هستند.
- سفت شدن لاستیکی چسبهای ساختمانی:
بسیاری از چسبهای ساختمانی ، پلیمرهای لاستیکی حل شده ای در خودشان دارند. وقتی که چسبها سخت میشوند، لاستیک به صورت قطراتی با قطر حدود 1µm رسوب میکند. لاستیکهای استفاده شده در این روش شامل پلی وینیل فرمال (pvf) و پلی وینیل بوتیرال (PVB) هستند که هر دو بوسیله واکنش آلدئید مناسب با پلی وینیل الکل ساخته میشوند.
- سیلیکونها:
چسبهای یک جزئی سیلیکون اغلب به چسبهای ولکانیزه شونده در دمای اطاق (rtv) معروفند و شامل پلی دی متیل سیلوکسان (PDMS) با جرمهای مولکولی در محدود 1600-300 با گروههای انتهای استات ، کتوکسیم یا اتر هستند. این گروهها توسط رطوبت اتمسفر ، هیدرولیز شده ، گروههای هیدروکسیل تشکیل میدهند که بعدا با حذف آب متراکم میشوند.
چسبهای سیلیکونی نرم و مطلوب هستند و دارای مقاومت محیطی و شیمیایی خوبی هستند. این چسبها به عنوان بهترین پوشش برای استفاده در حمام شناخته شدهاند.
 |
| چسب چوب |
چسبهایی که بدون واکنش شیمیایی سخت میشوند
این چسبها شامل سه نوع زیر میباشند
- چسبهایی که در اثر حذف حلال سخت میشوند:
- چسبهای تماسی: چسبهای تماسی احتمالا از معروفترین چسبها بر پایه حلال هستند. اینها محلولهایی از پلیمر در حلال آلی هستند که در دو سطح بکار میروند تا متصل شوند. ماده اصلی این چسبها ، لاستیک پلی کلروپرن (پلی کروپرن ، پلی کلرو بوتادین) است و برای چسباندن روکشهای تزئینی و پلاستیکهای محکم دیگر مثل ABS , DVC به چوپ و محصولات فلزی و چسبهای تماسی DIY برای تخت کفش بکار میروند.
- چسبهای پمادی: چسبهای بر پایه حلال مشهور که در ظروف پماد مانند به عموم فروخته میشوند، اغلب محلولهایی از لاستیک نیتریل (همیپلیمر یا بوتادین و آکریلونیتریل) در حلالهای آلی هستند.
- چسبهای تماسی: چسبهای تماسی احتمالا از معروفترین چسبها بر پایه حلال هستند. اینها محلولهایی از پلیمر در حلال آلی هستند که در دو سطح بکار میروند تا متصل شوند. ماده اصلی این چسبها ، لاستیک پلی کلروپرن (پلی کروپرن ، پلی کلرو بوتادین) است و برای چسباندن روکشهای تزئینی و پلاستیکهای محکم دیگر مثل ABS , DVC به چوپ و محصولات فلزی و چسبهای تماسی DIY برای تخت کفش بکار میروند.
- چسبهایی که با از دست دادن آب سخت میشوند:
- محلولهای آبی و خمیرها: نشاسته ، ذرت و غلات ، منابع عمده برای استفاده چسب هستند. موارد مصرف عمده برای چسباندن کاغذ ، مقوا و منسوجات میباشد. کاربردهای آن شامل صفحات موجدار ، پاکتهای کاغذی ، پنجرگیری تیوپ ، چسباندن کاغذ دیواری و چسبهای تر شدنی مجدد با آب میباشد. چسبهای تر شدنی توسط آب شامل پلی (وینیل الکل) (DVOH) که در تمبرهای پُستی مورد استفاده قرار میگیرند و از لاتکس صمغهای طبیعی (مثلا صمغی و دکسترین) و پلی وینیل استات (DVN) همراه با مقدار زیادی DVOH پایدار کننده تولید میشوند. DVOH تنها پلیمرمعروفی است که از منومر خودش ساخته نمیشود.
- امولسیونهای آبی: اجزا ترکیبی برای پلیمریزه شدن امواسیونی عبارتند از: آب ، منومرها ، پایدار کننده ها و آغازگر. محصول پلیمر شدن امولسیونی ، شیرابه ای از ذرات پلیمر با پایدار کنندههای جذب شده میباشد. معروفترین مثال ، چسب چوب DIY است که شیرابه آن ، شامل پلیمر پلی وینیل استات (DVA) است و به میزان زیادی در کارهای کارگاهی و در چسباندن اتصالات تاق و زبانه برای درها ، پنجره ها و مبلمان در کارخانهها استفاده میشود و مثال دیگر در رنگهای امولسیونی بر پایه DVA هستند که برای پوشش سطح یا به عنوان چسب استفاده میشود.
- محلولهای آبی و خمیرها: نشاسته ، ذرت و غلات ، منابع عمده برای استفاده چسب هستند. موارد مصرف عمده برای چسباندن کاغذ ، مقوا و منسوجات میباشد. کاربردهای آن شامل صفحات موجدار ، پاکتهای کاغذی ، پنجرگیری تیوپ ، چسباندن کاغذ دیواری و چسبهای تر شدنی مجدد با آب میباشد. چسبهای تر شدنی توسط آب شامل پلی (وینیل الکل) (DVOH) که در تمبرهای پُستی مورد استفاده قرار میگیرند و از لاتکس صمغهای طبیعی (مثلا صمغی و دکسترین) و پلی وینیل استات (DVN) همراه با مقدار زیادی DVOH پایدار کننده تولید میشوند. DVOH تنها پلیمرمعروفی است که از منومر خودش ساخته نمیشود.
- چسبهایی که به وسیله سرد کردن سخت میشوند:
- چسبهای ذوبی: ماده اولیه چسبهای ذوبی که از ابزار تفنگ شکلی خارج میشود، معمولا اتیلن وینیل استات (EVA) میباشد. کاربرد این چسبها شامل استفاده در جعبههای مقوایی ، صفحه کتاب ، اتصالات حرارتی و نئوپان میباشد. از دیگر چسبهای ذوبی میتوان چسبهای ذوبی پلی آمیدی ، پلی اورتان ، استرهای آلیفاتیک ، پلی استر اشاره کرد.
چسبهای حساس به فشار
چسبهای حساس به فشار ، دائما چسبناک باقی میمانند و به خاطر استفاده در نوار چسبها و برچسبها معروف هستند. این چسبها بطور عمده بر پایه لاستیک طبیعی ، همی پلیمر دستهای و تصادفی ، استیرن - بوتادین و آکریلیک هستند. PVC نرم شده و پلی اتیلن ، مواد نوار معمولی هستند. یک طرف نوار با یک آستری یا لایه زیری پوشیده شده است. به همین دلیل ، چسب دائما چسبناک میماند و طرف دیگر ، دارای پوشش آزاد کننده ای است که وقتی که نوار باز میشود، با چسب جدا میگردد. مواد آزاد کننده که اغلب استفاده میشود، همی پلیمری از وینیل الکل و وینیل اکتادسیل کاربامات است که در اثر واکنش با DVOH با اکتادسیل ایزوسیانات ساخته میشود.
معایب و مزایای چسبها
معایب
- عموما چسبها بوسیله آب یا بخار آب سست میشوند.
- محدوده رهایی کار آنها کمتر از چسبانندههای فلزی (مهره ها ،پیچ ها و بستهای آهنی و غیره) است.
- چسبها توسط دمای تبدیل شیشه ای (Tg) و تخریب شیمیایی محدود شدهاند.
مزایا
- اتصال مواد غیر مشابه و لایههای نازک از مواد
- گسترش بار بر روی یک ناحیه وسیع
- زیبایی و حالت آئرودینامیک آنها بر روی سطوح خارجی اتصال
- کاربرد آنها با استفاده از ماشین روبات میباشد.



دید کلی
شیشه از نظر ساختمان مولکولی در حالت جامد آرایش مولکولی نامنظم دارد. در درجه حرارتهای بالا ، شیشه مثل هر مایع دیگری رفتار میکند. اما با کاهش دما ، گرانروی آن بطور غیر عادی افزایش مییابد و باعث میشود مولکولها نتوانند در آرایشی که لازمه کریستال شدن است، قرار گیرند. به این ترتیب شیشه از نظر ساختمان مولکولی مانند مایعات نامنظم است، ولی این ساختمان غیر منظم ، دیگر متحرک نیست.
شیشه جسمی سخت است که سختی آن در حدود 8 میباشد و همه اجسام بجز الماسهها را خط میاندازد. وزن مخصوص شیشه 2.5 گرم بر سانتیمتر مکعب بوده و بسیار تُرد و شکننده است. شیشه در مقابل تمام مواد شیمیایی حتی اسیدهای قوی و بازها مقاومت کرده و تحت تاثیر خورندگی واقع نمیشود، به همین علت ظرف آزمایشگاهی را از شیشه میسازند. فقط اسید فلوئوریدریک (HF) بر آن اثر داشته و شیشه را در خود حل مینماید.
تاریخچه
شیشه گری ، یکی از قدیمیترین حرفههایی است که بشر بدان اشتغال داشته است. مصریها سازنده اولین اشیای شیشهای بودهاند که ظروف بدست آمده از حفاریهای مصر قدمت 5000 ساله دارد. رومیان نیز در فن شیشه گری مهارت داشتهاند و در این صنعت از سایرین پیشرفتهتر بودند. رونق شیشه سازی در نخستین ادوار تاریخ اسلامی صورت گرفته است، زیرا هنری بود که در مساجد و زیارتگاهها و تزئینات مذهبی جلوه خاصی داشته و مورد استفاده قرار میگرفت.
در ایران نیز ساختن شیشه قدمت چند هزار ساله دارد. و نخستین واحد ماشینی تولید شیشه ساختمانی در ایران در سال 1340 شروع بکار کرد.
ترکیبات سازنده شیشه
اجزای اصلی تشکیل دهنده شیشه
با نگاه به جدول عناصر ، کمتر عنصری را میتوان یافت که از آن شیشه بدست نیاید، ولی سه ماده کربنات دو سود ، سنگ آهک و سیلیس ، مواد اصلی تشکیل دهنده شیشه میباشند. مواد شیشه ساز مورد تایید موسسه استاندارد و تحقیقات صنعتی ایران عبارتند از سیلیس (SiO2) ، دیاکسید بور (B2O3) ، پنتا اکسید فسفر (P2O5) که از هر کدام بتنهایی میتوان شیشه تهیه نمود.
گدازآورها
کربنات سدیم (Na2CO3) ، کربنات پتاسیم (K2CO3) و خرده شیشه ، سیلیکات سدیم و پتاسیم (Na2SiO3 , K2SiO3) که حاصل ترکیب سیلیس با گدازآورها میباشند، در آب حل میشوند و از شفافیت شیشه به تدریج کم میکنند. به همین علت است که اغلب شیشههای مصرف شده در گلخانه پس از چند سال کدر میشوند و نور از آنها بخوبی عبور نمینماید.
تثبیت کنندهها
برای آنکه مقاومت شیشه را در مقابل آب و هوا ثابت کنیم، باید اکسیدهای دو ظرفیتی باریم ، سرب ، کلسیم ، منیزیم و روی به مخلوط اضافه کنیم که به این عناصر ، ثابت کننده میگویند.
تصفیه کنندهها
موجب کاستن حباب هوای موجود در شیشه میشوند و بر دو نوعند:
- فیزیکی: سولفات سدیم (Na2SO4) ، کلرات سدیم (NaClO3). با ایجاد حبابهای بزرگ حبابهای کوچک را جذب و از شیشه مذاب خارج میکنند.
- شیمیایی: املاح آرسنیک و آنتیموان ترکیباتی ایجاد میکنند که حبابهای کوچک داخل شیشه را از بین میبرند.
تا اینجا به موادی اشاره کردیم که عدم وجودشان ، در مواد اولیه باعث از بین رفتن مرغوبیت کالا میشد. حال به چند ماده دیگر که به نوعی در تولید شیشه سهیم هستند، اشاره میکنیم.
افزودنیها
- استفاده از بوراکس به جای اکسید و کربنات سدیم (گدازآور) که در اثر حرارت به Na2O و B2O3 تجزیه میشود و در واقع بجای هر دو ماده عمل میکند.
- استفاده از نیترات سدیم NaNo3برای از بین بردن رنگ سبز شیشه (ناشی از اکسید آهن که همراه مواد دیگر وارد کوره میشود).
- استفاده از اکسید منگنز که باعث مقاومت بیشتر در مقابل عوامل جوی و شفافتر شدن شیشه میشود.
- استفاده از اکسید سرب PH3O4 , PbO به جای CaO برای ساختن شیشههای مرغوب بلور و کریستال که باعث درخشندگی شیشه میشوند.
- برای ساختن کریستال مرغوب از اکسید نقره استفاده میکنند.
- استفاده از فلدسپار که باعث مقاومت بهتر در مقابل مواد شیمیایی میشود.
- برای اینکه شیشه در برابر اسید فلوئوریدریک هم مقاوم باشد، ترکیباتی از فسفات به آن میافزایند.
- استفاده از خرده شیشه که به ذوب مواد سرعت بیشتری میدهد.
- استفاده از اکسید فلزات برای تهیه شیشههای رنگی.
- اکسید سزیم برای جذب اشعه زیر قرمز و اکسید بر برای ازدیاد مقاومت حرارتی مورد استفاده قرار میگیرند.
دو نمونه از عناصر تشکیل دهنده که عمومیت بیشتری دارند، در زیر ذکر میگردد.
- ترکیبات(1): اکسید سیلیسیم (SiO2) در حدود 74 تا 80 درصد و بقیه شامل پراکسید سدیم (NaO2) تا 15 درصد و اکسید کلسیم 7 تا 12 درصد اکسید منیزیم 2 تا 4 درصد و 2 درصد هم عناصر دیگر مانند Fe2O3 - MnO - Al2O3 - TiP2 - SiO3.
- ترکیبات (2): اکسید سیلیسیم (SiO2) در حدود 73 درصد ، اکسید سدیم 15 درصد ، اکسید کلسیم 5.55 درصد ، اکسید منیزیم 3.6 درصد ، اکسید آلومینیوم 1.5 درصد ، اکسید بور (B2O3) و اکسید پتاسیم( K2O) هر کدام 0.4 درصد ، اکسید آهن (Fe2O3) و اکسید سیلیسیم 6 ظرفیتی SiO3 هر کدام 0.3 درصد.
علاوه بر مواد فوق همیشه مقداری خرده شیشه نیز با این مواد وارد کوره میگردد.

انواع شیشه و کاربرد آنها
شیشه به اشکال مختلف مورد استفاده قرار میگیرد. در ساخت لوازم تزیینی مانند گل ، تابلو و غیره در ساختن ظروف آزمایشگاهی و یا ظروف آشپزخانه مانند لیوان ، بطری و غیره و بالاخره در ساختن شیشههای مسطح که در دو نوع ساده و مشجر عرضه میگردد و مصارف مختلفی دارد که عمده ترین کاربرد آن به عنوان در و پنجره در کارهای ساختمانی است که به شکلهای مختلف اعم از شیشههای شفاف ، نیمه شفاف و رنگی ، جاذب حرارت ، ایمنی ، دوجداره ، سکوریت و... وجود دارد.
همچنین در آینه سازی ، صنایع نشکن ، صنایع یخچال سازی ، میزهای شیشهای ، انواع شیشه رومیزی و تیغه کاری ساختمان کاربرد دارد.
شیشه رنگی
به دو طریق میتوان شیشه رنگی بدست آورد.
- با افزودن و کم کردن بعضی مواد شیمیایی در مصالح اولیه تهیه شیشه. برای نمونه اکسیدهای مسی به شیشه رنگهای مختلف قرمز میدهد و رنگ آبی پر رنگ بوسیله اکسید کبالت بدست میآید. رنگ زرد با افزودن مقداری اکسید اورانیوم و کادمیوم حاصل می گردد.
- شیشه سفید را در شیشه مذاب رنگی فرو میکنند تا دو روی آن رنگی شود. شیشههای رنگی در ویترین مغازهها ، نمایشگاهها ، آزمایشگاهها و ساختمانهای صنعتی بکار میروند.
شیشه ضد آتش (پیرکس)
همراه مواد اولیه این شیشهها در مقابل حرارت ، مقاومت زیادی دارند، مقدار زیادی اکسید بوریک بکار میرود و سیلیس آنها از انواع شیشههای معمولی بیشتر است. معمولا از آنها به عنوان ظروف آزمایشگاه و آشپزخانه و یا در جلوی بخاریهای دیواری و اجاقها استفاده مینماید.
شیشه مسطح
این نوع شیشه را با اضافه نمودن توری فلزی در میان شیشه میسازند و بیشتر برای درهای ورودی ، کارگاهها ، موتورخانهها ، آسانسورها و هر جایی که خطر شکستن و فروریختن شیشه وجود دارد، استفاده مینمایند.
شیشه دوجداره (مضاعف)
این نوع شیشهها ، از دو لایه ساده و گاهی رنگی که به موازات یکدیگر قرار گرفتهاند و لبهها یا درزهای آنها هوابندی شده است و فضای بین آنها با مواد خشک کنندهای مانند سیلیکاژل ، پُر و یا در بعضی از موارد بین دو لایه ، خلاء ایجاد میشود. این نوع شیشه که عایق گرما ، سرما و صداست، در بسیاری از ساختمانها مانند فرودگاهها ، هتلها و بیمارستانها بکار میرود.
شیشه سکوریت
در این حالت ، شیشه مجددا تا حدود 700 درجه سانتیگراد حرارت داده و بعد بطور ناگهانی و تحت شرایط خاص و کنترل شدهای سرد میشود. این عمل باعث افزایش مقاومت شیشه (حدود 3 الی 5 برابر) در مقابل ضربه و نیز شوکهای حرارتی میگردد. این شیشهها در صورت شکستن ، به ذرات ریز و مکعب شکل تقسیم میشوند که آسیب رسان نیستند. از این نوع شیشه در ویترین فروشگاهها ، درهای شیشهای و پنجرههای جانبی اتومبیلها استفاده میگردد.

شیشه نشکن
این نوع شیشهها شامل دو یا چند لایه شیشهاند که بوسیله ورقههایی از نایلون شفاف تحت حرارت و فشار به هم متصل میشوند. همچنین بعضی از انواع شیشههای طلقدار به عنوان عایق صوتی ، جاذب حرارت ، کاهنده شفافیت و شیشه ایمنی بکار برده میشوند. وقتی که این شیشهها میشکنند، خاصیت کشسانی نایلون مانع از پخش و پراکندگی ذرات شیشه میگردد.
از جمله کاربردهای این نوع شیشهها در خودروها و ویترین مغازههایی که اشیاء گرانقیمت میفروشند استفاده میگردد. ممکن است شیشه نشکن را از جنس شیشه سکوریت بسازند.
شیشه ضد گلوله
از چند لایه شیشه سکوریت و یا نشکن ، شیشه ضد گلوله میسازند. در هنگام وارد شدن گلوله به داخل شیشه ، از نیروی آن کاسته و در میان شیشه متوقف میگردد.
شیشه انعکاسی (بازتابنده)
در این نوع شیشهها ، یک سطح شیشه با یک پوشش منعکس کننده نور و حرارت از جنس فلز یا اکسید فلزی دارای این خاصیت پوشانده میشود. این نوع شیشهها ، نور خورشید را منعکس میکنند و در کاهش حرارت و درخشندگی نور موثر هستند. اگر در روشنایی روز از بیرون به شیشه انعکاسی نگاه کنیم مشاهده میکینم که تصاویر اطراف را مانند آینه باز میتاباند و اگر از داخل به بیرون نگاه کنیم، شیشه کاملا شفاف خواهد بود. شبها پدیده مذکور برعکس است. یعنی شیشه از خارج شفاف و از داخل مانند آینه است.
این شیشه با منعکس نور خورشید ، حرارت ناشی از تابش نور خورشید را بطور قابل ملاحظهای کاهش میدهد و در نتیجه ، باعث صرفه جویی در هزینههای احداث ، راه اندازی و نگهداری سیستمهای تهویه و تبدیل میشود.



دید کلی
شیمی کوانتومی ، دانش کاربرد مکانیک کوانتومی در مسایل مربوط به شیمی است. اثر شیمی کوانتومی ، در شاخههای وابسته به شیمی قابل لمس است. مثلا :
- علمای شیمی فیزیک ، مکانیک کوانتومی را (به کمک مکانیک آماری) در محاسبات مربوط به خواص ترمودینامیکی (مانند آنتروپی و ظرفیت حرارتی) گازها ، در تفسیر طیفهای مولکولی به منظور تائید تجربه خواص مولکولی (مانند طولها و زوایای پیوندی) ، در محاسبات نظری خواص مولکولی ، برای محاسبه خواص حالات گذار واکنشهای شیمیایی به منظور برآورد ثابتهای سرعت واکنش ، برای فهم نیروهای بین مولکولی و بالاخره برای بررسی ماهیت پیوند در جامدات بکار میبرند.
- علمای شیمی آلی از مکانیک کوانتومی ، برای برآورد پایداریهای نسبی مولکولها ، محاسبه خواص واسطههای واکنش ، بررسی ساز و کار واکنشهای شیمیایی ، پیش بینی میزان ترکیبات و تحلیل طیفهای NMR استفاده میکنند.
- علمای شیمی تجزیه از مکانیک کوانتومی برای تفسیر شدت و فرکانسهای خطوط طیفی استفاده میکنند.
- علمای شیمی معدنی از نظریه میدان لیگاند که یک روش تقریبی مکانیک کوانتومی است، در توضیح خواص یونهای مرکب فلزات واسطه سود میبرند.
فرضیه پلانک ، سرآغاز مکانیک کوانتومی
در سال 1900، "ماکس پلانک" ، نظریهای ابداع کرد که با منحنیهای تجربی تابش جسم سیاه ، مطابقتی عالی از خود ارائه داد. فرض او این بود که اتمهای جسم سیاه ( مادهای که تمام نورهای تابیده به آن را جذب کند ) ، تنها قادرند نورهایی را گسیل سازند که مقادیر انرژی آنها توسط رابطه hv داده میشود. در رابطه ، v فرکانس تابش و h ، ثابت تناسب است که به ثابت پلانک معروف است. با قبول مقدار 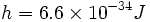 ، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.
، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.
به دنبال پلانک ، "انیشتین" نیز مشاهدات مزبور را بر اساس اندیشه تشکیل نور از اجزایی ذره گونه تشریح کرد که آنها را فوتون نامید که انرژی هر یک از آنها برابر است با: 
احتمال و مکانیک کوانتومی
موضوع احتمال ، یک نقش اساسی را در مکانیک کوانتومی ایفا میکند. در مکانیک کوانتومی ، سروکار ما با احتمالاتی است که با متغیر پیوستهای مانند مختصه x درگیرند. صحبت از احتمال پیدا شدن یک ذره در یک نقطه خاص مانند x = 0.5000 حاوی چندان معنایی نیست، زیرا تعداد نقطهها در روی محور x نامتناهی ، ولی تعداد در اندازه گیریهای ما به هر حال متناهی است و از این رو ، احتمال وصول با دقت به 0.5000 بینهایت کم خواهد بود.
این است که به جای آن از احتمال یافتن ذره در یک فاصله کوتاه از محور x ، واقع بین x+dx , x صحبت میشود که در آن dx یک طول بینهایت کوچک است. طبیعتا احتمال فوق متناسب با فاصله کوچک dx بوده و و برای نواحی مختلف محور x متغیر خواهد بود. بنابراین احتمال اینکه ذره در فاصله مابین x و x+dx پیدا شود، مساوی g(x)dx است که در اینجا (g(x بیانگر نحوه تغییرات احتمال روی محور x است. تابع (g(x چون برابر مقدار احتمال در واحد طول است، لذا چگالی احتمال نامیده میشود.
چون احتمالات ، اعداد حقیقی و غیر منفیاند، لذا (g(x باید یک تابع حقیقی باشد که همه جا غیر منفی است. تابع موج 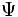 میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل میپذیرد که چگالی احتمال برابر
میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل میپذیرد که چگالی احتمال برابر 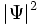 است.
است.
اصل عدم قطعیت هایزنبرگ
اندیشه "بوهر" مبنی بر اینکه هر الکترون در اتم ، تنها میتواند کمیتهای معین انرژی را دارا باشد، گام مهمی در رشد و تکوین نظریه اتمی بود (مدل اتمی بوهر). نظریه بوهر برای توجیه طیف اتم هیدروژن ، مدلی رضایت بخش ارائه کرد، اما تلاش برای بسط نظریه به منظور تشریح طیف اتمهای دارای بیش از یک الکترون ناموفق بود. دلیل این مشکل به زودی آشکار شد.
در نگرش بوهر ، الکترون به عنوان ذرهای باردار متحرک ، در نظر گرفته میشود. برای پیش بینی دقیق مسیر یک جسم متحرک ، دانستن مکان و سرعت جسم در هر لحظه معین ضروری است. اصل عدم قطعیت هایزنبرگ (1926) نشان میدهد که تعیین دقیق مکان و اندازه حرکت جسمی به کوچکی الکترون ناممکن است. هرچه تلاش کنیم که یکی از این کمیتها را دقیقتر تعیین کنیم، از دقت کمیت دیگر ، نامطمئنتر هستیم.
مشاهده اشیا با دریافت انعکاس پرتوهای نوری که برای روشن کردن آنها بکار رفته است، امکانپذیر است. برای تعیین موقعیت جسمی به کوچکی یک الکترون ، تابشی با طول موج به غایت کوتاه مورد نیاز است. چنین تابشی ، طبعا فرکانس بسیار بالایی خواهد داشت و بسیار پرانرژی خواهد بود. وقتی این تابش به الکترون برخورد کند، سبب تغییر تندی و جهت حرکت آن میشود. از این رو هر گونه تلاش برای تعیین موقعیت الکترون ، اندازه حرکت آن را به شدت تغییر میدهد. فوتونهایی که طول موج بلندتر دارند، کم انرژیترند و تاثیر کمتری بر اندازه حرکت الکترون میگذارند، ولی به علت بلندی طول موجشان ، نخواهند توانست موقعیت دقیق الکترون را نشان دهند.
از این رو ، این دو نوع عدم قطعیت با هم مرتبطند. به گفته هایزنبرگ ، حاصلضرب عدم قطعیت در مورد یک شیء ، 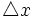 و عدم قطعیت در اندازه حرکت آن ،
و عدم قطعیت در اندازه حرکت آن ، 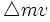 ، برابر یا بزرگتر از حاصل بخش ثابت پلانک ، h و 4π است:
، برابر یا بزرگتر از حاصل بخش ثابت پلانک ، h و 4π است:

عدم قطعیت در اندازه گیری ، برای اشیایی به کوچکی الکترون بسیار مهم است، در حالی که برای اشیا با اندازه معمولی بیاهمیت است.

معادله شرودینگر
اصل عدم قطبیت هایزنبرگ نشان میدهد که هر نوع کوشش در راه جامعتر و دقیق کردن مدل بوهر ، بینتیجه است، زیرا تعیین دقیق مسیر الکترون در یک اتم ناممکن است. از سوی دیگر ، "شرودینگر" ، رابطه دوبروی را برای تدوین معادلهای بکار برد که الکترون را برحسب خصلت موجی آن توصیف میکند.
معادله شرودینگر پایه مکانیک موجی است. معادله برحسب یک تابع موجی 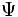 برای الکترون نوشته میشود. وقتی معادله برای الکترون در اتم هیدروژن حل میشود، یک سلسله تابع موجی بدست میآید. هر تابع موجی به یک حالت معین انرژی برای الکترون مربوط است و ناحیهای در اطراف هسته را توضیح میدهد که در آن ، امکان یافتن الکترون وجود دارد. تابع موجی یک الکترون آنچه را که یک اوربیتال نامیده میشود، توضیح میدهد.
برای الکترون نوشته میشود. وقتی معادله برای الکترون در اتم هیدروژن حل میشود، یک سلسله تابع موجی بدست میآید. هر تابع موجی به یک حالت معین انرژی برای الکترون مربوط است و ناحیهای در اطراف هسته را توضیح میدهد که در آن ، امکان یافتن الکترون وجود دارد. تابع موجی یک الکترون آنچه را که یک اوربیتال نامیده میشود، توضیح میدهد.
شدت هر موج ، با مجذور دامنه آن متناسب است. تابع موجی ، 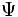 ، تابع دامنه است. مقدار
، تابع دامنه است. مقدار 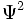 برای یک حجم کوچک در هر موقعیتی در فضا ، متناسب با چگالی بار الکترونی در آن حجم است.
برای یک حجم کوچک در هر موقعیتی در فضا ، متناسب با چگالی بار الکترونی در آن حجم است.
میتوان تصور کرد که بار الکترون به سبب حرکت سریع الکترون به صورت ابر باردار در فضای دور هسته گسترده شده است. این ابر در برخی نواحی غلیظتر از نواحی دیگر است. احتمال یافتن الکترون در هر ناحیه معین متناسب با چگالی ابر الکترونی در آن ناحیه است. این احتمال در ناحیهای که ابر الکترونی غلیظتر است، بیشتر خواهد بود. این تفسیر کوششی برای توصیف مسیر الکترون ، به عمل نمیآورند، بلکه فقط پیش بینی میکند که احتمال یافتن الکترون در کجا بیشتر است.

با سلام . به وبگاه رسمی علم و دانش خوش آمدید ! من شایان شیت ره هستم دانش آموز دبیرستان سلام صادقیه ! این پروژه تحقیقی بنده است . تا این جا 77 مطلب ثبت گردیده . امید وارم از این مطالب نهایت استفاده رو ببرید . با تشکر مدیریت !
بازدید دیروز : 16
کل بازدید : 46104
کل یاداشته ها : 77