دید کلی
عطرها موادی هستند که انسانها برای اینکه خوشبو باشند و در نزد دیگران مقبول ، از آنها استفاده میکنند. عطرهایی که از مواد طبیعی بدست میآیند، مانند مشک آهوی ختن ، اندکند. اغلب این مواد ، از مواد شیمیایی و بصورت سنتزی تولید میشوند. با ساختار عطرها آشنا میشویم.

مواد سازنده عطر
هر نوع عطر دستکم از سه جزء تشکیل یافته است که فراریت و وزن مولکولی آنها تا حدی باهم تفاوت دارند.
جزء اول
جزء اول که تاپ نوت نامیده می شود، فرارترین ماده و مشخصترین بو را در دارا بوده و در تولید عطر کاربرد دارد.
جزء دوم
جز دوم که میدل نوت نامیده می شود، کمتر فرار است و عموما عصاره یک گل (بنفشه ، یاس و غیره) است.
جزء سوم
آخرین جزء یا اندنوت ، کمترین فراریت را دارد و معمولا یک رزین یا پلیمر مومی است.
سیوتون ، اصلیترین سازنده عطر
بیشتر عطرها اجزای بسیاری دارند و از لحاظ شیمیایی غالبا مخلوطهای کمپلکس هستند. با پیشرفت تجزیه مواد عطر طبیعی ، مصرف ترکیبات آلی سنتزی خالص که بوی آنها همانند بوی عطر خاصی میباشد، بسیار معمول شده است. نمونه آن سیوتون ، یک کتون حلقوی است که از سیویت بدست میآید. سیویت ، مادهای است که از غدههای گربه سیویت ترشح میشود.
گربه سیویت ، حیوانی شبیه به گربه است که در اتیوپی و افریقای مرکزی یافت میشود. سیوتون در عطر سازی ارزش بسیار دارد. امروزه سیوتون بصورت سنتزی موجود است. برای سنتز سیوتون ، نخست 8 ، هگزادکان ـ1 ، 16، دی کربوکسیلیک اسید تهیه میکنند و سپس آنرا بصورت حلقه در میآورند. یون توریم (Th+4) کاتالیزور بسته شدن این حلقه است.
سیویت ، مانند مشک ، مجموعهای از مواد جاذب جنسی است. این مواد جاذب جنسی در عطرهای موثر با زیرکی بوسیله بوهای گل و گیاهی پوشانده میشوند. جاذبه اولیه از بوی خوش حاصل میشود. اما اثر اساسی ناشی از سیویتون یا مشک است.
سایر ترکیبات عطر
ترکیبات دیگری که در عطرها بکار میروند، شامل الکلها و استرهایی با وزن مولکولی زیادند. یک نمونه ، ژرانیول (با نقطه جوش 230 درجه سانتیگراد) یک جزء اصلی از روغن ژرانیوم (شمعدانی معطر) ترکیهای است. استرهای این الکل ، برای ساختن ماده معطر سنتزی که بوی رز دارد، در عطرسازی بکار میرود. مثلا استری که از واکنش میان ژرانیول و اسید فرمیک تشکیل میشود، بوی رز دارد.
عطرها نوعا 10% تا 25% اسانس عطر و 75% تا 80% الکل و یک ثابت کننده برای نگه داشتن روغنهای اسانسی دارد. عطرها به بیشتر مواد آرایشی افزوده میشوند تا محصول بدست آمده بوی مطلوب داشته باشند؛ این مواد بوهای طبیعی و دیگر اجزایی مانند مواد جاذب جنسی را میپوشانند. آنها بعلت داشتن الکل ، خاصیت ضدعفونی و باکتریکشی ملایمی دارند.
مواد دافع بو
حدود 2 میلیون غده عرق بر سطح بدن دست اندرکار تنظیم دمای بدن هستند. این غدهها با ترشح آب که تبخیر آن اثر خنک کنندگی دارد، دمای بدن را تنظیم میکنند. از این تبخیر ، اجزای جامدی به جای میماند که عمدتا سدیم کلرید و مقادیر کمتری پروتئین و دیگر مواد مرکب آلی است. بوی بدن بیشتر از آمینها و مواد حاصل از هیدرولیز روغنهای چرب (اسیدهای چرب ، آکرولیین و غیره) است که از بدن و از رشد باکتریایی در باقیمانده حاصل از غدههای عرق گسیل می یابند. برای آنکه بدن انسان وظایف خود را به خوبی انجام دهد، عمل تعریق هم امری عادی و هم ضروری است. خود عرق کاملا بی بو است، اما محصولات تجزیه باکتریایی چنین نیستند.

انواع مواد دافع بو
مواد دافع بو از سه نوع عمده هستند:
- یک نوع آنها ، بطور مستقیم تعرق را میخشکاند یا بعنوان مواد منقبضکننده عمل میکنند.
- نوع دیگر آنها که بو دارند و بوی عرق را میپوشانند.
- نوع سوم آنها که ترکیبات بودار را با واکنش شیمیایی برطرف میکنند. از جمله موادی که بعنوان قابض عمل میکنند، آلومینیم سولفات آبپوشیده ، کلرید آلومینیم آبپوشیده (O2H6 . 3AlCl) ، آلومینیم کلروهیدرات ( در واقع آلومینیم هیدروکسی کلرید ) و الکلها هستند.
مواد بیبو کننده
از جمله مواد مرکبی که بعنوان عوامل بیبو کننده عمل میکنند، روی پروکسید ، روغنهای اسانسی و عطرها و انواعی از مواد ضد عفونی کننده ملایم هستند. روی پروکسید ، مواد مرکب بودار را با اکسید کردن آمینها و ترکیبات اسیدهای چرب بر طرف میکند. روغنهای اسانسی ، عطرها یا بوها را جذب میکنند یا آنها را میپوشانند و ضدعفونی کنندهها معمولا عوامل اکسید کننده یا کاهندهای هستند که باکتریهای ایجاد کننده بو را میکشند.


محلول سوسپانسیون ، (Supension) ، محلول کلوئیدی است که در آن ذرات معلق جامد به صورت مولکولهای مجاز در یک مایع باشد. مانند آب گل آلود. محلول سوسپانسیون را "محلول تعلیقی" نیز مینامند.

تعریفی از محلولهای کلوئیدی
محلولهای کلوئیدی را محلولهای چسب مانند نیز میگیوند. پراکندگی ذرات آنها به صورت پراکندگی یونی و مولکولی نیست، بلکه به صورت مجموعههای مولکولی به نام "میسل" می باشند که به راحتی از حلال قابل تشخیص هستند، مانند ذرات گچ یا قطرات روغن زیتون در آب ، بطوری که محلولهای غیر حقیقی یا همان محلولهای کلوئیدی مخلوط یکنواخت نیستند.
تفاوت محلولهای کلوئیدی و سوسپانسیون با محلولهای حقیقی
در محلولهای کلوئیدی و سوسپانسیون مسیر نور مشخص است و نور در آن منعکس و پراکنده میشود. ولی در محلول حقیقی مسیر نور مشخص نیست (عبور نور بدون انتشار صورت می گیرد) و ذرات کلوئیدی برخلاف محلول حقیقی قابلیت دیالیز ندارند. یعنی از غشای نیم تراوا عبور نمیکنند. بنابراین از روش دیالیز برای جدا کردن اجسام این دو دسته استفاده میکنند.
تفاوت محلولهای کلوئیدی و محلولهای سوسپانسیون
گفتیم که ماهیت محلولهای کلوئیدی و محلول سوسپانسیون یکی است و در اصل سوسپانسیون ، زیر مجموعهای از محلول کلوئیدی به حساب میآید. تنها تفاوت در اندازه ذرات است. اندازه ذرات محلولهای سوسپانسیون و امولسیون بزرگتر از محلول کلوئیدی و اندازه محلولهای کلوئیدی بزرگتر از محلول حقیقی است. در محلولهای کلوئیدی واحدهای جسم محلول خود به خود ذراتی حجیم میباشند و یا اینکه از چندین مولکول بزرگ مجتمع شده بدست آمده است. نشاسته به وزن مولکولی تقریبی 32000 از نوع اول و گوگرد از نوع دوم است.
این ذرات که امکان دارد از چندین هزار مولکول تشکیل شده باشد، به قدری ریز است که با چشم غیر مسلح دیده نمیشود و در نتیجه چنین محلولی در صورت ظاهر به محلول حقیقی شباهت پیدا میکند. لیکن اگر ذرات به بزرگی 6-10 میلیمتر ، به بزرگی 3-10 میلیمتر برسد، با میکروسکوپ قابل رویت میگردد و در نتیجه نام محلول کلوئیدی به محلول سوسپانسیون تبدیل میشود و لذا حالت کلوئیدی را میتوان حالت واسطه بین محلول واقعی و محلول سوسپانسیون دانست.
تفاوت محلول امولسیون و محلول کلوئیدی
امولسیون ، کلوئیدی است که در آن ذرات معلق یک مایع در مایع دیگر است. مانند تعلیق روغن در آب . در حالیکه سوسپانسیون ذرات معلق جامد در مایع است.
تبدیل کلوئیدی و سوسپانسیون به لخته
به هم چسبیدن ذرات کلوئید و سوسپانسیون یا معلق را به یکدیگر و ته نشین شدن آنها را به صورت ذرات بزرگتر ، لخته شدن میگویند و اگر به صورت توده نیمه جامد تبدیل شوند، آن را ژله شدن مینامند.



نگاه کلی
منظور از پاک کنندهها (detergehts) ، موادی هستند که ذرههای چربی و چرک را از پارچهها و یا اجسام دیگر بزدایند و در انواع مختلف تهیه میشوند. اولین ماده ای که به عنوان شوینده ساخته شد، صابون بود. از عمر صابون صدها سال میگذرد. آخرین دستگاههای صابون کشف شده ، مربوط به 2000 سال پیش است، 700 سال است که صابونسازی بطور صنعتی و به مقادیر زیاد ساخته میشود و 200 سال است که ساخت آن ، متحول گشته و به صورت کلاسیک و مدرن در آمده است.
از آن زمان تا کنون ، تعداد شویندهها به حدی رسیده که قابل شمارش نیست، بطوری که امروزه در حجم انبوهی از شویندهها ، به همراه تبلیغات آنها مواجه شدهایم. در حال حاضر در برخی کشورها ، تقریبا بیش از 80 درصد از مواد پاک کننده مصرفی از شویندههای سنتزی تهیه میشوند. لکن در مصارف عمومی واژه صابون ، مشخص کننده یک نمک فلز قلیایی یا آمونیوم یک اسید کربوکسیلیک راست زنجیر با تعداد 10-18 اتم کربن است و نام مواد شوینده به مواد صناعی با ساختمان مشابه اطلاق میشود. از این مواد ، در مصارف عدیده ای از جمله برای پاک کردن ، شستشو و در فرایندهای نساجی و غیره استفاده میگردد.
از طرف دیگر ، صابونهای فلزی ، کربوکسیلاتهای قلیایی خاکی یا فلزات سنگین با زنجیره طویل هستند. این صابونها در آب نامحلول بوده و در سیستمهای غیر آلی ، به عنوان مثال مواد افزودنی به روغنهای روان کننده ، جلوگیری کننده از زنگ زدگی ، ضد آب کردن مواد و سوختهای ژلاتیندار (مواد سوختنی مانند بنزین که با مواد غلیظ کننده ممزوج شدهاند و از آنها در بمبهای ناپالم و شعله افکنها استفاده میشود) ، قارچکشها دارای کاربرد میباشد.
خصوصیت قابل توجه این است که عدم توازن پلاریته (قطبیت) در داخل مولکول صابونها و مواد شوینده و پاک کننده ، موجب ابراز قابلیت انحلال و ماهیت فاز غیر معمول در حلالهای قطبی و غیر قطبی میشود. این رفتار ، دقیقا باعث سودمندی چنین ترکیباتی در زمینههای خیس شوندگی ، قابلیت انحلال ، شویندگی (در مورد شستشو و خشک شویی بصورت ترامان) ، رنگرزی و بسیاری از سایر فراوردههای صنعتی و خانگی است.
ترکیب اساسی ساختمان مولکولی پاک کنندهها موجب بوجود آمدن چنین صفاتی میگردد.

انواع مواد پاک کننده
صابون (Soap)
صابونها را میتوان از هیدرولیز قلیایی چربیها و روغنهای طبیعی (استر اسیدهای چرب با گلیسرول) مانند پیه ، روغنهای نارگیل ، زیتون ، نخل و تالو تهیه کرد که این واکنش به نام فرایند صابونی شدن (Saponification) موسوم است:
باید توجه داشت که در روشهای جدید ، از هیدرولیز مستقیم چربیها بوسیله آب در دمای زیاد استفاده می شود. این موضوع ، تصفیه و ایزولاسیون اسیدهای چرب را که به صابونها خنثی میشوند، ممکن ساخته، اساس یک فرایند پیوسته را بوجود میآورد. از نقطه نظر شیمیایی ، صابونها ، نمکهای فلزی اسیدهای چرب (اسیدهای کربوکسیلیک) راستزنجیر با حدود 10-18 اتم کربن میباشند.
با اینکه همه نمکهای فلزی اسیدهای چرب ، صابون هستند، اما تنها نمکهای قلیایی مانند (سدیم و پتاسیم) در آب حل میشوند و خاصیت پاککنندگی دارند. نمکهای فلزهای قلیایی خاکی (مانند کلسیم و منیزیم و..) در آب حل نمیشوند. از این رو صابونهای معمولی در آب سخت در مجاورت یونهای کلسیم و منیزیم رسوب میکنند. به این ترتیب صابون خوب کف نمی کند و خاصیت پاک کنندگی خود را از دست میدهد.
نمکهای آلومینیوم اسیدها نیز در آب نامحلول و در روغنها محلول هستند و از این ماده ، در چربیهای نرم کننده ، رنگ ، روغن جلا و ضد آب کردن مواد استفاده میشود. نمک اسیدهای فلزات سنگین مانند کبالت یا مس نیز بعنوان ماده خشک کننده در رنگهای ساختمانی و جوهر ، قارچ کش ها و مواد ضد آب استفاده میشود.
کیفیت و مرغوبیت صابون ، به نوع چربی روغن بکار رفته بستگی دارد. لذا از خالصترین و بیبو ترین آنها استفاده میگردد. علاوه بر چربی و قلیا مواد افزودنی دیگری هم در فرمولاسیون صابون وارد میشوند. این مواد عبارتند از:مواد جلوگیری کننده از اکسیداسیون مثل تری اتانول آمین اولئات ، مواد جلوگیری کننده از فساد صابون مانند دی سیانو دی آمیدو سدیم سولفانیلات ، روغنهای معطره برای ایجاد بوی خوب صابون و غیره.
پاک کننده های سنتزی (Synthetic detergents)
مواد شوینده سنتزی که امروزه بسیار مورد استفاده قرار میگیرند، مانند صابون ، از یک زنجیر هیدروکربن متصل به نمک یک اسید محلول در آب تشکیل شده است. البته در تهیه این پاک کنندهها باید توجه داشت که طول زنجیر و نوع هیدروکربن مورد استفاده بطور مناسب انتخاب گردد. از گروههای قطبی مشتق شده از اسید سولفوریک در حد بسیار عمومی برای جایگزینی کربوکسیلات استفاده میگردد.
بعنوان مثال میتوان به آلکیل سولفاتها (ROSO3Na) ، آلکان سولفوناتها (RSO3Na) و آلکیل آریل سولفوناتها (R-C6H4-SO3Na) اشاره کرد و از مهمترین این مواد میتوان سدیم لوریل (دودسیل) سولفات (C12H25-OSNa) و سدیم دودسیل بنزن سولفونات (C12H25-C6H4-SO3-Na) را که دارای قدرت پاک کنندگی بالایی هستند، نام برد. استرها و آمید اسیدهای چرب نیز که از تورین (H2NCH2CH2SO3H) و اسیدایزاتیونیک (HOCH2CH2SO3H) تهیه میشوند، از جمله اولین ترکیبات سنتزی تلقی میشوند. مضافا ، آلکان فسفوناتها معرف نوع دیگری از مواد صناعی آنیونی میباشد.
از طرف دیگر احتمال دارد که تغییر و اصلاح گروههای قطبی بوسیله تغییر در علامت بار الکتریکی یون فعال در سطح مسیر شود. یک مثال بسیار معروف از مواد شوینده کاتیونی (invert soaps) ، ملح آمونیوم نوع چهارم این طبقه بفرمول C16H33N(CH3)Br است. در طبقه دیگر یعنی مواد شوینده غیر معدنی ، گروه قطبی عبارت از گروه آب دوست غیر مجتمع شده میباشد که معمولا حاوی چند گانگی وظایف اکسیژن (اتر و الکل) است که در پیوند هیدروژنی با آب برگزیده شده است. مثالی در این مورد ، استر تهیه شده از یک اسید چرب و قند است.
از انواع عمومی دیگر ، میتوان به پلیمریزاسیون تعدادی از واحدهای اکسید اتیلن با یک الکل اشاره کرد که دارای فرمول عمومی R-O-(CH2CH2O)2H میباشد. همچنین اکسیدهای آمین مانند R-N(CHsub>3)2→O و اکسیدهای فسفین منسوب آنها نیز تهیه شدهاند. مهمترین شوینده های سنتزی عبارتند از:
صابون مایع
صابون مایع ، در واقع از نظر مواد تشکیل دهنده ، جزو صابونها محسوب نمیشود و از پاک کننده های سنتزی میباشد. البته اگر در ساختمان معمولی از روغن نارگیل زیاد و یا روغن هایی مثل روغن بزرک استفاده شود، میتوان صابون را به صورت مایع در آورد. صابونهای مایع ، علاوه بر ماده اولیه و اصلی خود ، دارای مواد دیگری مثل نرم کننده ، پاک کننده و کف کننده ، ضد باکتری و چرب کننده هستند.

شامپوها
شامپوها نیز از پاک کننده های سنتزی هستند. ماده اصلی تشکیل دهنده شامپوها عبارتند از: عامل پاک کننده که خود شامل سه دسته مواد فعال سطحی آنیونی (مثل سدیم لوریل اتر سولفات و تری اتانول آمین سولفات ، آمفوتری (مثل بتائین کوکوآمیدوپروپیل) و غیر یونی هستند. عامل تقویت کننده کف (مثل بتائین) ، عامل حالت دهنده مو و عامل نگهدارنده (مواد ضدعفونی کننده و میکروب کش) ، عامل صدفی کننده مثل اتیلن گلیکول و عامل غلیظ کننده مثل نمک طعام و عامل رنگ و بو مثل عصاره گیاهان.
پودرهای لباسشویی
پودرها ماشین لباسشویی نسبت به پودرهای رختشویی چند ماده اضافه دارند که بر قدرت پاک کنندگی آنها میافزاید. یکی از این مواد ، پر بورات است که از سفید کننده ها و رنگ برهاست. اجزای اصلی پوردهای لباسشویی شامل موارد زیر هستند:
ماده اصلی و فعال (مواد غیریونی و آنیونی) که عامل پاک کنندگی و جدا کردن چرک از لباس است، عامل قلیایی کننده (مثل سیلیکات ها) که از خوردگی بدنه لباسشویی جلوگیری می کند، عامل سفیدکننده و رنگ سرکه معمولا پربورات سدیم است، عامل کنترل کننده کف و پاک کننده کمکی ، عامل کاهش سختی آب که به پاک کنندگی هم کمک میکند (مثل فسفات ها) ، عامل جلوگیری از رسوب مجدد چرک مثل CMC از شستن دوباره چرک روی لباس جلوگیری میکند، اپتیکال براتیز که باعث درخشندگی پارچه میشود، مواد میکروب کش و ضدعفونی کننده.
سفید کننده ها و رنگ برها
بسیاری از لکه برها موادی هستند که از آنها به عنوان سفید کننده ، ضدعفونی کننده و پاک کننده استفاده میشود. رایج ترین ماده ای که از آن به عنوان سفید کننده استفاده میشود، آب ژاول است که خاصیت ضدعفونی کننده نیز دارد، زیرا یک سفید کننده کلردار است و از سفید کننده های دیگر ، پربورات سدیم است که از آن ، بیشتر در خشک شوییها و نیز در ترکیب پودرهای ماشین لباسشویی استفاده میشود. قدرت سفیدکنندگی پربورات از آب ژاول کمتر است.
آب اکسیژنه یا پراکسید هیدروژن هم یک ماده رنگ بر و سفید کننده است. علاوه بر مواد ذکر شده ، موادی مثل الکل ، آمونیاک ، استن ، اسید نیتریک ، اسید اگزالیک ، تربانیتن ، جوش شیرین ، کربنات سدیم ، تتراکلریدکربن و غیره نیز خاصیت رنگ بری و پاک کنندگی دارند.
قیاس صابون و پاک کننده های سنتزی
صابونها در هنگام واکنش با ناخالصیهای یونهای فلزی موجود در آبهای طبیعی ، بویژه کلسیم و منیزیم ، منجر به تشکیل نمکهای نامحلول در آب میشوند و به صورت رسوب از آب جدا میشوند. اما نمکهای فلزات قلیایی خاکی و املاح فلزات سنگین مواد شوینده سنتزی در آب محلول هستند. لذا این شوینده ها در آب سخت نیز پاک کنندگی خوبی دارند و رسوب جدید تشکیل نمیدهند.
صابونهای کربوکسیلات در PH پایین ، هیدرولیز شده و به صورت صابون اسیدی نامحلول راسب میشوند، ولی شوینده های سنتزی ، پایداری زیادی در برابر اسیدیته از خود نشان میدهند. زیرا پاک کننده های صابونی ، نمکهایی هستند که آنیون تشکیل دهنده آنها ، به اسیدهای ضعیف تعلق دارند و در محیط اسیدی به راحتی هیدرولیز میشوند.
از دیگر تفاوتهای شوینده های سنتزی با صابونها ، تغییر و اصلاح در ساختار این مواد نسبت به مولکول صابون است که باعث ایجاد بهترین حالت تعادلی آب دوستی ف چربی دوستی و خصوصیات انحلال پذیری ، اثر میکروب کشی و ایجاد نرمی در منسوجات و غیره میشود.
پاک کننده های سنتزی به تنهایی از نظر قدرت پاک کنندگی با صابونها معادل نیستند، اما دو افزاینده مهم ، قابلیت تخمیر کنندگی آنها را به نحو قابل ملاحظه ای افزایش میدهد. سدیم تری پلی فسفات که به عنوان یک سازنده بکار میرود، قابلیت شکستن و تعلیق برخی از خاکهای رسی ، رنگها و سایر مواد جامد بسیار ریز محلول در آب را داراست. بعلاوه این جسم با تعداد زیادی از یونهای فلزی ، کیلیت تشکیل میدهد.اک کننده های خانگی ، همچنین محتوی نیم تا یک درصد کربوکسی متیل سلولز (CMC) هستند که این جسم ، از واکنش سلولز با کلرواستیک اسید در محلول بازی تهیه میشود.
این ماده پلیمری ، قادر است که از رسوب مجدد جرم بر روی منسوجاتی که به وسیله پاک کننده ها پاک شده است، جلوگیری کند. سایر افزاینده های معمولی عبارتند از: مواد سفید کننده ، مواد کف زا و یا سایر مواد تنظیم کننده میباشد.

علت اثر پاک کنندگی مواد پاک کننده
ذره های چربی و چرک ، جامدند و به پارچه یا بدن میچسبند و با شستشوی ساده و بوسیله آب زدوده نمیشوند، اما با صابون و دیگر شوینده ها شسته میشوند. اثر پاک کنندگی صابون وشوینده ها به این دلیل است که مولکول آنها از دو قسمت آبدوست (هیدروفیل) و آب گریز یا چربی دوست (هیدروفوب یا لیپوفیل) تشکیل شده است. قسمت آبدوست که همان سر نمکی صابون COO- یا گروه سولفات و دیگر گروههای قطبی در انتهای مولکول مواد شوینده است، مولکولهای آب را جذب میکند و در آب محلول میباشد و بوسیله حلالهای آلی دفع میشود. سر دیگر مولکولهای صابون و مواد شوینده سنتزی یک هیدروکربن با زنجیر طولانی است که آب را از خود دفع میکند، ولی در حلالهای آلی حل میشود.
پس از حل شدن مولکولهای صابون در آب از طریق قسمت یونی ، از بهم پیوستن زنجیرهای هیدروکربنی آب گریز ، مجموعه های بسیار کوچکی بوجود میآیند که سطح خارجی آن را آنیونهای آبدوست میپوشانند. این مجموعه های کوچک با مولکولهای آب ، پیوند هیدروژنی تشکیل میدهند و به صورت ذره های شناور در آب باقی میمانند.
بدین ترتیب مولکول صابون مانند پلی بین ذرات چربی و آب قرار گرفته، به واسطه انحلال ذرات چربی و چرک در ذره های شناور صابون از روی الیاف پارچه یا اجسام دیگر به داخل آب کشیده میشوند و با شستشو پاک میشوند. در شوینده های سنتزی نیز چربی ها و چرکها به زنجیر آلکیل می چسبند و گروه سولفونات سبب حل شدن آنها در آب شده، همراه با آب برده میشوند.
مواد پاک کننده و آلودگی محیط زیست
مواد شیمیایی می توانند در چرخه های طبیعی وارد و در مرحله ای خاص بوسیله باکتریها تجزیه شوند. به عنوان مثال چربیهای موجود در طبیعت که مولکولهای آنها شاخه جانبی در زنجیره هیدروکربنی ندارند و صابون معمولی را از آنها میسازند، بوسیله باکتریها تجزیه میشوند. تعدادی از شوینده های شنتزی ، بویژه آلکیل بنزن سولفوناتهای مشتق شده از مواد شیمیایی نفت ، دارای شاخه جانبی در زنجیره هیدروکربنی میباشند و توسط باکتریها تجزیه میشوند. از این رو ، باقی ماندن و تراکم این مواد غیر طبیعی ساخته دست بشر در طبیعت ، سبب آلودگی روزافزون آبها و مخازن زیرزمینی میشود.
برای جلوگیری از آلودگیهای روزافزون حاصل از این نوع پاک کننده ها ، هم اکنون در بسیاری از کشورها ، قوانین و مقررات ،اجازه استفاده از مواد شوینده مقاوم در برابر تجزیه بیولوژیکی (شوینده های سخت) را نمیدهد و کارخانجات بسوی تولید مواد شوینده نرم با ساختمانهای راست زنجیر سوق داده شدهاند. اشکال اساسی دیگر شوینده های سنتزی ، ترکیبهای فسفردار آنهاست که برای تنظیم PH و جلوگیری از واکنش یونهای کلیسم و منیزیم موجود در آب سخت با ماده شوینده ، به آن افزوده میشود. فسفاتها در اعماق رودخانه ها و دریاچه ها رسوخ کرده، سبب رشد غیر عادی قارچها و جلبکها میشوند و به این ترتیب با مصرف اکسیژن محلول در آب توسط این گیاهان ، زندگی ماهی ها و دیگر آبزیان به خطر میافتد.


امولسیون کلوئیدی است که در آن ، ذرات معلق یک مایع در مایع دیگر است، مانند تعلیق روغن در آب.

تفاوت بین محلول کلوئیدی و محلول امولسیون
همان گونه که در تعریف ذکر شده ، امولسیون (و همینطور سوسپانسیون) ، زیر مجموعهای از محلول کلوئیدی به حساب میآیند. تنها تفاوت اساسی که میتوان قائل شد، در اندازه ذرات محلول امولسیون و محلول کلوئیدی است. بطوری که اندازه ذرات محلول سوسپانسیون و امولسیون بزرگتر از محلول کلوئیدی است و محلول کلوئیدی نیز دارای ذرات بزرگتر از محلولهای حقیقی است. اندازه ذرات محلول امولسیون در حدود  میلیمتر است، در حالی که اندازه ذرات محلول کلوئیدی در حدود
میلیمتر است، در حالی که اندازه ذرات محلول کلوئیدی در حدود 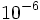 میلیمتر است.
میلیمتر است.
تفاوت محلول امولسیون با محلول حقیقی
در محلولهای کلوئیدی و امولسیون (و سوسپانسیون) ، مسیر نور مشخص است و نور در آن منعکس و پراکنده میشود، ولی در محلول حقیقی مسیر نور مشخص نیست. یعنی عبور نور بدون انتشار صورت میگیرد و ذرات کلوئیدی برخلاف محلول حقیقی قابلیت دیالیز ندارند، یعنی از غشاء نیم تراوا عبور نمیکنند. بنابراین از روش دیالیز برای جدا کردن اجسام این دو دسته استفاده میکنند.
نمونهای از یک امولسیون حیاتی
مانند انحلال ، حالت کلوئیدی منحصر به دو فاز جامد و مایع نیست، بلکه سایر حالات ماده هم میتواند دو به دو چنین حالتی را بوجود آورد که هر کدام به اسمی بین عامه مشهور شده است. چنانکه کف ، حالت کلوئیدی حباب هوا در مایع است و مه و ابر ، تفوق مایع در گاز است و شیر معمولی ، مخلوط دو مایع میباشد که همان امولسیون است.
تفاوت بین امولسیون ، لخته شدن و ژل
همانطور که گفته شد، به پخش و پراکندگی مایع در مایع دیگر ، امولسیون گفته میشود که بطور کلی آنها را به دو دسته متمایز تقسیم میکنند: سیستم آب در روغن و سیستم روغن در آب. اما ممکن است که فاز و محیط پخش ، یک جامد ، و ذرات پخش شونده ، یک مایع باشد. در این صورت یک ژل بدست میآید که مانند کلوئیدها و امولسیون سیلان ندارد. به عبارت دیگر ، به هم چسبیدن ذرات کلوئید را به یکدیگر و ته نشین شدن آنها را به صورت ذرات بزرگتر ، لخته شدن میگویند و اگر به صورت توده نیمه جامد تبدیل شوند، آن را ژله شدن مینامند.



تاریخچه و سیر تحولی عکاسی
در سال 1727، "T.H.Schulze" با بعضی از ترکیبات نقره آزمایشهایی انجام داد. در حقیقت او میکوشید که تصویر صفحه مشبک را بر روی سطحی که پوشیده از مخلوط گچ ، نقره ، اسید نیتریک و سایر مواد شیمیایی بود، بوجود آورد. او دریافته بود که کلرور نقره ، یکی از مهمترین مواد در عکاسی ، بوسیله نور ، سیاه میشود.
در سال 1802 ، "Humphrey Davy" و "T.Wedgewook" ، سعی کردند تصویر سایه واری را با استفاده از نور و روش شولز بوجود آوردند. آنها از محلول نیترات نقره که روی کاغذ مالیده بودند، استفاده کرده ، جهت ثبت تصویر از دوربینی به نام آبسکورا (جعبه تاریک) استفاده کردند. این وسیله ، جعبه بدون منفذ و بسته ای بود که فقط در قسمت جلوی آن ، یک سوراخ کوچک یا یک عدسی ساده قرار داشت که تصویر را روی کاغذ میانداخت و این اولین باری بود که با استفاده از عدسیها و فعل انفعالات شیمیایی ، ضبط تصور ممکن شد.
اما تصویر حاصل شده ، به علت آنکه که هنوز نمیدانستند چگونه املاح نقره اضافی را برای جلوگیری از سیاه شدن آن از بین ببرند، بعد از گذشت زمان تیره میشد. تا اینکه در سال 1837 توسط "J.B.Reade" خاصیت تیوسولفیت سدیم (هیپو) که مواد حساس به نور را در مناطق نور نخورده روی کاغذ زایل میساخت، کشف شد. محلول هیپو با ترکیبات نقره ، ترکیباتی را بوجود میآورد که به راحتی در آب حل میشد و از روی فیلم و یا کاغذ ، زایل میگردید.
اولین عکس رنگی
اولین عکس رنگی نیز در تاریخ 17 مه سال 1861 ، بوسیله Clerk Maxwellدر انجمن سلطنتی انگلستان به نمایش گذاشته شد. البته نمیتوان گفت که عکس رنگی خوب و ایده آلی ارائه شد، ولی به هر حال با این کار ، فرایند روش رنگی توضیح داده شد. در سال 1870 ، "دکتر مارکس" ، طریقه ساختن امولسیونی را که با استفاده از ژلاتین و مخلوط کردن آن با برومورنقره بدست میآمد، معرفی کرد.
صفحات پوشیده از این امولسیون ، برای استفاده در دوربین به دست مصرف کنندگان میرسید. امروزه امولسیون تقریبا با همان روش قبلی آماده و مصرف
میشود.
فرایندهای عکاسی
فرایندهای انجام شده برای ثبت تصویر در عکاسی ، عبارتند از: نوردهی ، ظهور ، ثبوت ، شستشو.
نوردهی
در نتیجه هدایت نور، خواه به وسیله دوربین عکاسی دلخواه و خواه بوسیله هر دستگاه عملی دیگر ، بر روی سطحی حساس ، تصویری دید آمده و ثبت میشود که "تصویر مخفی" نامیده میشود. تصویر مخفی ، قابل رویت نبوده و فقط با اعمال روشهای خاص بعدی یعنی عمل ظهور میتوان آن را قابل رویت ساخت و در حقیقت ، زمانیکه مواد عکاسی (فیلم تخت ، فیلم حلقهای ، کاغذ) در دوربین ، اگراندلسیور یا دستگاه چاپ ، نور میبیند، هالوژنهای نقره درون امولسیون آنها به وسیله نور متاثر شده، موجب بروز فعل و انفعالات شیمیایی میشود و در نتیجه تصویر مخفی بوجود میآورد که بعدها در اثر عمل ظهور قابل رویت میشود.
امولسیونهای عکاسی
خمیر مایه حاصل از پخش یکنواخت هالوژنهای نقره (کلرور نقره یا برمورنقره یا یدورنقره) ژلاتین را "امولسیون عکاسی" مینامند. تهیه امولسیون یکی از کارهای دقیق و حساس در عکاسی است و مراحل تولید آن به شرح زیر میباشد: معادله شیمیایی که اساس تولید امولسیون عکاسی میباشد، عبارت است از:
برای تهیه امولسیون به شکل ساده آن ، محلول ده درصد نیترات نقره را به محلولی که شامل ژلاتین و کلرورپتاسیم است، افزوده و آن را به شدت به هم میزنند، به این ترتیب ، بلورهای بسیار ریز کلرور نقره (AgCl) به تدریج و به مقدار زیاد بدست میآید. سپس امولسیون حاصل را تا میزان مشخصی که معمولا حدود 90 درجه فارینهایت (33 درجه سانتیگراد) است، برای چندین ساعت حرارت میدهند. طی این عمل بلورهای هالوژن نقره (کلرور نقره) که بسیار ریز و دارای حساسیت کم است در محلول حل شده ، به دانه های بزرگتر تبدیل میشوند که این دانهها هم یکنواختتر و هم نسبت به نور حساستر هستند.
کلیه این اعمال فقط با وجود ژلاتین قابل اجراست. برای تکمیل امولسیون ، مواد شیمیایی دیگری نظیر عامل سختکننده جهت جلوگیری از شل شدن و حل شدن امولسیون در مراحل مختلف ظهور ، عامل حساس کننده جهت افزایش حساسیت امولسیون به رنگهای مختلف طیف نور و غیره به آن میافزایند.
سپس امولسیون آماده شده برای مصرف ، نسبت به نوع استفاده ای که از آن خواهد شد، روی سطوحی چون شیشه ، فیلم و کاغذ و غیره مالیده و بستهبندی میشود.

حساسیت هالوژنهای نقره به نور
اگر در تهیه امولسیون ، به جای کلرورپتاسیم ، برمورپتاسیم بکار برده شود، برمورنقره (AgBr) و یا یدور نقره (AgI) تولید میشود که آنها نیز حساس به نور هستند. این سه ترکیب را هالوژنهای نقره مینامند که از اجزاء اصلی امولسیونهای مورد مصرف در غالب زمینههای عکاسی هستند و حساسیت هالوژنها به نور به ترتیب کلرور ، برمور و یدور نقره افزایش مییابد. به این ترتیب که برمورنقره حساستر و یا سریعتر از کلرونقره است. در نتیجه میتوان گفت که امولسیون مورد مصرف در ساختن فیلمها ، بیشتر از برمور نقره و گاهی هم در صد کمی از یدور نقره تشکیل میشود.
هالوژنهای نقره فقط قسمتی از طیف نور یعنی طول موجی در حدود 500 میلی میکرون را جذب میکنند و با افزودن مواد حساس کننده ، حساسیت امولسیون به نور بیشتر میشود. مثلا پاره ای از مواد آلی ، امولسیون را نسبت به اشعه ماوراء بنفش حساس میکنند و بعضی از این مواد حتی قادرند حساسیت فیلم را تا طول موجی برابر 1250 میلی میکرون گسترش دهند.
بسیاری از این امولسیون های حساس به اشعه ماوراء بنفش در عکسبرداری هوایی ، ستاره شناسی و سایر تحقیقات علمی و فنی که نیاز به عکسبرداری دارند، حائز اهمیت بسیاری هستند.
فرایند ظهور در عکاسی
فرایندی که طی آن ، در اثر فعل و انفعالات شیمیایی محلولهای ظهور با املاح نقره نورخورده درون امولسیون ، تصویر مخفی به تصویر قابل رویت تبدیل میشود، عمل ظهور نامیده میشود. تصویر مخفی ، متشکل از بلورهای بسیار ریز نورخورده املاح نقره است و زمانی که در تماس با ظاهر کنندهها قرار میگیرد، هالوژنهای نقره به نقره آزاد ، احیا شده و از تجمع نقره آزاد ، تصویر شکل میگیرد و عامل ظهور نیز اکسید میشود.
محلولهای ظهور عکاسی
محلولهای ظهور ، امولسیونهای سیاه _ سفید بسیار متنوعی هستند و میتوان گفت، برای هر منظوری ، از محلول ظهور خاصی استفاده میشود. ولی بطور کلی محلولهای ظهور ، حاوی مواد زیر میباشند:
حلال
برای مخلوط کردن مواد شیمیایی مختلف یک فرمول ظهور ، از آب بعنوان حلال استفاده میشود، از آن رو که محلول حاصله بتواند در امولسیون ، نفوذ کرده و جذب آن شود. در برخی از مواد خاص ، مثل بعضی از انواع ظاهر کنندههای غلیظ ، مواد حل کننده دوم و یا سومی نیز لازم است تا مواد شیمیایی به صورت محلول بمانند. ماده ای مثل دیاتیلن گلیکول که به عنوان نگهدارنده مواد آلی بکار میرود.
عامل ظهور
عوامل ظهور ، ترکیبات شیمیایی پیچیده آلی هستند که وقتی در محلول ظهور حل میشوند، دارای قابلیتی میشوند که هالوژنهای نقره نورخورده را ظاهر میسازند. ولی با هالوژنهای نور نخورده هیچگونه فعل انفعالاتی انجام نمیدهند. به عبارت دیگر ، آنها احیا کننده های هستند که الکترونهای لازم جهت احیا شدن یونهای نقره و تبدیل آنها به فلز نقره را آزاد میکنند.
بیشتر عوامل ظهور که بطور معمول از آنها استفاده میشود، از خانواده بنزن هستند که عبارتند از: هیدروکینون ، اِلون با نام شیمیایی پاراآمینوفنل ، کاتکول (C4H4(OH)4) ، دیانول ، دولمی ( (C6H3OH (NH3Cl2) ، کودورول (OH , C6H4.NH(CH3COOH) ، آمیدول ، گلیسین ، متول و...
مواد نگهدارنده (محافظ)
عامل نگهدارنده یا محافظ که معمولا سولفیت سدیم (Na2SO4 ) است. اکسیداسیون محلول ظهور را متوقف ساخته و از تیره شدن رنگ آن جلوگیری میکند. رنگ محلول ظهور اگر چه سرانجام در اثر استفاده تغییر میکند، لیکن وجود نگهدارنده در محلول باعث میشود که مقدار بیشتری امولسیون نور خورده در محلول ظاهر شده و رنگ آن هم دیرتر تغییر کند.
مواد فعال کننده
در محلولهای خنثی ، بسیاری از عوامل ظهور ، قادر به ظهور املاح هالوژنه نقره نور خورده نیستند. به همین دلیل ، در محلول ظهور از مواد قلیایی مخصوصی استفاده میشود تا عوامل ظهور را فعالتر سازند. افزایش فعالیت عامل ظهور با بکار بردن مواد قلیایی مختلف و میزان قدرت و ضعف آن ، کنترل میشود. معمولترین فعال کنندهها به ترتیب افزایش حالت قلیایی آنها عبارتند از: براکس (Na2B4O7,10H2O)، کدالک(NaBO4,4H2O)و کربنات سدیم (Na2CO3) و سود سوزآور (NaOH). سولفیت سدیم که به عنوان نگهدارنده هم مصرف میشود، دارای خاصیت قلیایی ضعیفی است و به همین دلیل در پاره ای موارد از ماده قلیایی دیگری استفاده نمیشود.
مواد مانع شونده (ضد خفگی)
ماده ضد خفگی ، ظهور هالوژنهای نقره نور نخورده را به تاخیر انداخته و یا از آن جلوگیری میکند. در حقیقت مانع از آن میشود که نقاطی در امولسیون که فاقد تصویر هستند، با ظهورشان سبب خفگی امولسیون شوند و معمولا از برمورپتاسیم بعنوان عامل خفگی استفاده میشود. یونهای برم حاصل از یونیزه شدن برمورپتاسیم به سطح بلورهای نقره جذب شده و باعث کاستن اثر محلول ظهور روی هالوژنهای نقره نور نخورده میشود و بنابراین از ظهور بیمورد آنها جلوگیری و در نتیجه ، حالت خفگی امولسیون هنگام ظهور کاملا از بین میرود.
اجزای ترکیبی دیگر
مواد متفرقه دیگری نیز گهگاه جهت مقاصد خاصی به محلول ظهور اضافه میشوند:
- در مواقعی که محلول ظهور در درجه حرارتهای بیش از معمول مورد استفاده قرار گیرد، به آن سولفات سدیم (NaSO4) اضافه میگردد تا از حل شدن ژلاتین در محلول و از هم پاشیدگی امولسیون جلوگیری شود.
- استفاده از تیوسولفات سدیم (NaCNS) برای از بین بردن و حل کردن جزئی از هالوژنهای نقره.
- استفاده از ماده شیمیایی ضد کلسیم ، باعث سنگینی آب و ایجاد رسوبهای لجن مانند در محلولهای ظهور و کثیف شدن سطح کاغذ چاپ هنگام ظهور میشود.
- در محلولهای ظهور رنگی نیز از مواد شیمیایی آلی پیچیده ای به نام "کوپلر جفتگر" استفاده میشود.
فرایند ثبوت در عکاسی
به دنبال عمل نوردهی ، فقط قسمتهایی از مواد حساس به نور ، تبدیل به تصویر مخفی شده که بعد از مرحله ظهور نمایان میشود. بخشی که تحت تاثیر نور قرار نگرفته و در مرحله ظهور تغییری نکرده است، با نور خوردن محدود ، سیاه میشود. برای جلوگیری از این امر ، از محلولهای شیمیایی خاصی به نام "حمام ثبوت" استفاده میشود. در واقع مقصود از به کار بردن حمام ثبوت این است که هالوژنهای نقره نور نخورده را از امولسیون جدا کرده و بدین وسیله تصویری ثابت و دایمی حاصل میشود.
حمام های ثبوت حاوی ترکیبات زیر میباشد: تیوسولفات سدیم "هیپو" Na2S2O3,5H2O و تیوسولفات آمونیوم NH4)2S2O3 ) برای حل کردن هالوژنهای نقره ، اسید ضعیفی مانند اسید استیک برای خنثی کردن ماده قلیایی که ممکن است از محلول ظهور به محلول ثبوت انتقال یابد، سولفیت سدیم بعنوان ماده نگهدارنده یا محافظ ، زاجها به عنوان سخت کننده امولسیون جهت جلوگیری از بوجود آمدن آسیبهای احتمالی فیزیکی مانند خراش و غیره هنگام شستشو ، بافرها برای ثبت PH محلول.
حل شدن هالوژنهای نقره نور نخورده
تیوسولفات "هیپو" با یونهای نقره ، ترکیب ثابتی را بوجود میآورد که این ترکیب از تمرکز یا افزایش تعداد یونهای نقره آزاد به طور موثری در محلول جلوگیری میکند. این امر سبب میشود که برمورنقره و سایر هالوژنهای نقره ، به تدریج و دائما در محلول حل شده و درنتیجه ، سدیم و آمونیوم موجود در محلول ثبوت ، مانند حلال هالوژنهای نقره عمل کنند.
فرایند شستشو در عکاسی
در فرایند عکاسی ، از آب جهت زدودن مواد شیمیایی که در هر مرحله ، درون امولسیون بوجود میآید و به خاطر عدم انتقال آن مواد به مراحل بعدی که سبب آلوده شده آن میگردد، استفاده میشود. همچنین ، از آب جهت شستشوی نهایی استفاده میشود تا مواد شیمیایی باقیمانده در امولسیون از آخرین مرحله آن (مرحله ثبوت) نیز کاملا زایل شده و باعث خرابی تدریجی تصویر نشود.
نگاتیف (تصویر منفی)
تصویری که طی مراحل ذکر شده حاصل میشود، کاملا مانند "موضوع" نیست؛ یعنی آنچه که سفید و روشن است در تصویر ، تیره و آنچه تیره و سیاه است در تصویر ، سفید دیده میشود. این محصول را تصویر منفی "نگاتیف" مینامند که باید با عمل چاپ ، تصویری بدست آورد تا شبیه موضوعی دیده شود که از آن عکسبرداری شده است. (تصویر مثبت)
ظهور مثبت (ریورسال)
فرایند ظهور مثبت ، بوجود آمدن تصویری مثبت و یا به عبارت دیگر ، تصویری مانند موضوع اصلی مورد عکسبرداری میشود. از این فرایند در تولید فیلمهای آماتوری عکاسی ، عکسهای مثبت "اسلاید" سیاه - سفید برای استفاده در تلویزیون ، تولید و تکثیر نسخههای خطی و نظایر آن در امور گرافیک و طراحی و چاپ و در پاره ای موارد در فیلمهای رنگی سینمایی ، تکثیر و تولید اسلایدهای نمایش و نظایر آن استفاده بسیاری میشود.
در فرایند ظهور مثبت ، برگردان (ریورسال) ، تصاویر منفی به طرق خاصی شستوش داده شده و از بین میروند و به بقیه مواد حساس نور نخورده ، مجددا تحت شرایطی نور داده شده و به جای آنکه عمل ثبوت روی آنها انجام گیرد، مرحله ظهور ادامه پیدا میکند. تصویر نهایی در این صورت شبیه موضوع اصلی خواهد شد.

فرایند ظهور رنگی
طی سال 1879 ، ملاحظه شد که بعضی از عوامل ظاهر کننده عکاسی ، هنگام ظهور تصاویر ، باعث سخت شدن ژلاتین نیز میشوند. ضخامت و میزان سخت شدن ژلاتین ، نسبت مستقیمی با مقدار نقره ای که هنگام ظهور مبدل به تصویر قابل رویت می شود، دارد. ژلاتین سخت نشده در قسمتهای بدون تصویر را میتوان با آب گرمی در حدود 120 درجه فارینهایت شسته و از بین برد. نتیجه و حاصل کار ، به صورت تصویر برجسته ژلاتین به جا میماند. این عمل را "ظهور برجسته" مینامند و اهمیت زیادی در برخی از فرایندهای ظهور چاپ رنگی دارد.
در ظهور برجسته ، عمل اکسیداسیون باید آزاد باشد تا در نتیجه ، محلول ، عملیات لازم را روی ژلاتین انجام داده و آن را سخت کند.
تصاویر برجسته ژلاتین تولید شده در عمل ظهور قادرند که نسبت به ضخامت خود ، اگر در محلولهای مناسب قرار گیرند، مقداری رنگ جذب کنند و رنگ جذب شده را به سطح مناسبی که در تماس کامل با خطوط برجسته تصویر قرار میگیرد، انتقال دهند.
در ظهور رنگی ، نقره (در امولسیون) به نسبت نوری که به هالوژنهای نقره تابیده شده، آزاد میشود و همزمان با آن ، مواد فرعی تولید شده در اثر اکسیداسیون محلول ظهور با جفتگرهای رنگی "کوپلرها" فعل و انفعالاتی انجام میدهد و در نتیجه تصویر رنگی به نسبت مقدار نقره آزاد شده حاصل میشود. بنابراین ، هنگام عمل ظهور رنگی ، تصویری که حاصل میشود متشکل از نقره و مواد رنگی به نسبتی است که نور به هالوژن خورده است.
این نکته لازم به تذکر است که قسمتی از مولکول جفتگرها در به وجود آوردن مواد رنگی و قسمت دیگر آن ، در تولید ماده ای قابل حل و نفوذ به طبقات مختلف امولسیون موثر است. نوع جفتگر و محلول ظهور ، در ثبات رنگ حاصله و حلال بودن آن تاثیر به سزایی دارند. آلفا- نفتول و کلرو- آلفا- نفتول دو نمونه ای از جفتگرهای رنگی هستند.
محلولهای ظهور رنگی
بطور کلی ، یک محلول ظهور رنگی دارای همان ترکیباتی است که یک محلول ظهور سیاه - سفید دارد. ترکیباتی چون عامل ظهور ، فعال کننده ، محافظ و عامل ضد خفگی و غیره. همچنین محلول ظهور دارای ترکیبات اضافی دیگری است، حتی اگر جفتگرهای رنگی در درون امولسیون باشند.
عامل ظهور رنگی
برای ظهور رنگی ، عامل ظهور به خصوصی مورد نیاز است که بتواند به واسطه عمل اکسیداسیون ، با جفتگیرهای رنگی ترکیب شده و تصویر رنگی را بوجود آورد. برای نمونه ، دی متیل- پارا- فنیلن دی آمین و 4- آمینو- ان- اتیل- ان- (بتا متان - سولفونامیدو اتیل)- ام- تولوییدن سسکوسولفات مونوهیدرات را میتوان نام برد.
عامل تشدید کننده
از الکل بنزیلیک ، جهت تسریع نفوذ عامل ظهور به همه لایه های مختلف امولسیون رنگی استفاده میشود و برای حل کردن هالوژنهای نقره از سولفات اتیلن دیآمین استفاده میشود.
عامل فعال کننده
برای این منظور ، از دو ماده شیمیایی قلیایی ، سود سوزآور و فسفات تری سدیک استفاده میشود.
عامل نگهدارنده (محافظ)
اگر چه در محلولهای ظهور رنگی از سولفیت سدیم به عنوان ماده محافظ استفاده میشود، اما غلظت آن خیلی کمتر از آن است که در محلولهای ظهور سیاه - سفید بکار میرود.
عامل ضد خفگی
برومورپتاسیم یا یدورپتاسیم با غلظت کمتر از آنچه که در محلولهای سیاه- سفید بکار میرود، به عنوان عامل ضد خفگی به کار برده می شود.
جفتگر کمکی
در بسیاری از ظهورهای رنگی ، کنترل میزان کنتراست رنگها مشکل است. به همین جهت ، ترکیبات خاصی چون اسید سیترازینیک را میتوان به محلول ظهور افزود تا با برخی از ترکیبات حاصله از اکسیداسیون درون محلول ترکیب شده و ماده بیرنگی تولید کند. این عمل ، میزان نقره و رنگهای حاصله از آن را در تصویر کنترل کرده و در نتیجه ، میزان کنتراست تصویر رنگی کنترل میشود.

با سلام . به وبگاه رسمی علم و دانش خوش آمدید ! من شایان شیت ره هستم دانش آموز دبیرستان سلام صادقیه ! این پروژه تحقیقی بنده است . تا این جا 77 مطلب ثبت گردیده . امید وارم از این مطالب نهایت استفاده رو ببرید . با تشکر مدیریت !
بازدید دیروز : 16
کل بازدید : 46112
کل یاداشته ها : 77